
酸碱理论35463
11页1、一、 比较重要的几种酸碱理论概念:1、电离论(水离子论):亦称阿仑尼乌斯酸碱理论。在水溶液中离解出的正离子全部是H+的化合物为酸;在水溶液中离解出的负离子全部是OH-的化合物是碱。 2、酸碱质子论:凡能给出H+的分子或离子为酸,凡能接受H+的分子或离子为碱。酸碱关系式为:酸碱+H+ 3、酸碱电子论:由路易斯(LewisGN)提出:凡能接受电子对的物质为酸;凡能给出电子对的物质为碱。酸碱反应的实质是形成了配位键。 4、软硬酸碱理论是在Lewis酸碱电子对理论基础上提出的。该理论是根据金属离子对多种配体的亲和性不同,把金属离子分为两类。一类是“硬”的金属离子,称为硬酸;另一类是软的金属离子,称为软酸。硬的金属离子一般是半径小,电荷高。在与半径小,变形性小的阴离子(硬碱)相互作用时,又较大的亲和力,这是以库仑力为主的作用力。软的金属离子由于半径达,本身又较大的变形性,在与半径大,变形性大的阴离子(软碱)相互作用时,发生相互间的极化作用(*软酸软碱作用),这是一种以共价键力为主的相互作用力。 二、软硬酸碱的特征1、硬酸:金属离子和其他Lewis酸的受体原子体积小,正电荷高,极化性低,对外层电子
2、抓得紧。如:H+;Li+;Na+;K+;Be2+;Fe3+;Ti4+;Cr3+ 软酸:金属离子及其他Lewis酸的受体原子体积大,正电荷低或等于零,极化性高,变形性大,也就是对外层电子抓得松。如:Cu+;Ag+;Au+;Cd2+;Hg2+;Pd2+和Pt2+;Hg22+及MO等。 3、交界酸:处于硬酸和软酸之间称为交界酸。如:Fe2+;Co2+;Ni2+;Cu2+;Zn2+;Pb2+;Sn2+;Sb3+;Cr2+;Bi3+等 4、硬碱:与硬酸能形成稳定的配合物的配体,即给予体原子电负性高,难极化,难氧化,也就是外层电子抓得紧,难失去,称为硬碱。如:NH3;F-;H2O;OH-;O2-;CH3COO-;PO43-;SO42-;CO32-;ClO4-;NO3-;ROH等 5、软碱:与软酸形成稳定配合物的配体,即配体原子具有低的电负性,容易极化和氧化,外层电子抓得松,称为软碱。如:I-;S2-;CN-;SCN-;CO;H-;S2O32-;C2H4;RS-等 6、交界碱:处于硬碱软碱之间称为交界碱。如:N3-;Br-;NO2-;SO32-;N2等 三、软硬酸碱规则及其应用 1、软硬酸碱(SHA
3、B)规则硬亲硬,软亲软,软硬交界就不管(处中间)2、应用:(1)化合物的稳定性:K稳Cd(CN)42-K稳Cd(NH3)42+热稳定性:HFHI (2)判断反应方向:ILi+CsF=LiF+CsIH=-63kJmol-12HgF2+BeI2=BeF2+HgI2H=-397kJmol-13AlI3+3NaF=AlF3+3NaIH=496kJmol-14BeI2+ZnF2=BeF2+ZnI2H=-277kJmol-1 (3)自然界元素存在形式矿物中Mg;Ca;Sr;Ba;Al等金属离子为硬酸,大都以氯化物、氟化物、碳酸盐、硫酸盐等形式存在,而Cu;Ag;Au;Zn;Pb;Hg;Ni;Co等低价金属为软酸,则以硫化物的形式存在。(4)类聚现象:键合在简单酸是的碱会影响酸的软硬度,如:BH3F-+BF3H-BF4-+BH4-向右进行CF3H+CH3FCF4+CH4向右进行由于在定界酸B()上键合了三个软碱H-,增加了B()的软度,使之更易接受软碱H-形成BH4-,而BF3H-更多被硬碱F-取代形成BF4-。这种软-软和硬-硬相聚和的趋势就称为类聚效应(SimbiosisEffect) (5)溶
4、解性在水溶液中,H2O含有电负性高的氧原子,是一种硬碱,但介于F-与其它卤素离子之间,Li+是典型硬酸,与F-键合强。LiF水肿溶解度小,而LiCl、LiBr、LiI易溶,易被H2O取代。而卤化银中,Ag+是软酸,与Cl-、Br-、I-键合较水强,这些盐溶解度就小,但Ag+与F-键合较水弱,AgF溶解度就大。 (6)反应速度:SHAB规则可预测反应速度,通常H-H结合或S-S结合化学反应速度就很迅速软硬酸碱理论the theory of hard and soft acids and bases软硬酸碱理论:将酸和碱根据性质的不同各分为软硬两类的理论。 概念:体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。将电负性高,极化性低难被氧化的配位原子称为硬碱,反之为软碱。硬酸和硬碱以库仑力作为主要的作用力;软酸和软碱以共价键力作为主要的相互作用力。 分类将酸和碱根据性质不同分为软硬两类的理论。1963年由R.G. 皮尔孙提出。1958 年 S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与 Ag+、Hg2+、Pt2+ 配位; 软硬酸
《酸碱理论35463》由会员飞****9分享,可在线阅读,更多相关《酸碱理论35463》请在金锄头文库上搜索。

2019年抚顺市第六中学高考生物简单题专项训练(含解析)

2019年教科版八年级物理上册全册学案

2019年宝鸡晨光中学高考生物简单题专项训练(含解析)

2019年象山港书院高考生物简单题专项训练(含解析)

2019年一级建造师工程经济考点总结

2019年小学教育教学工作总结4篇

2019年浙江省金华市中考数学试卷(解析版)
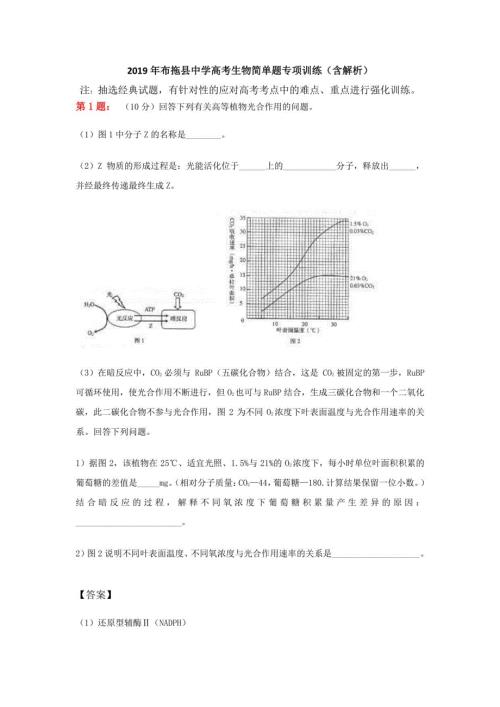
2019年布拖县中学高考生物简单题专项训练(含解析)

2010年卫生系列中级职称内科学风湿及结缔组织病习题及参考答案
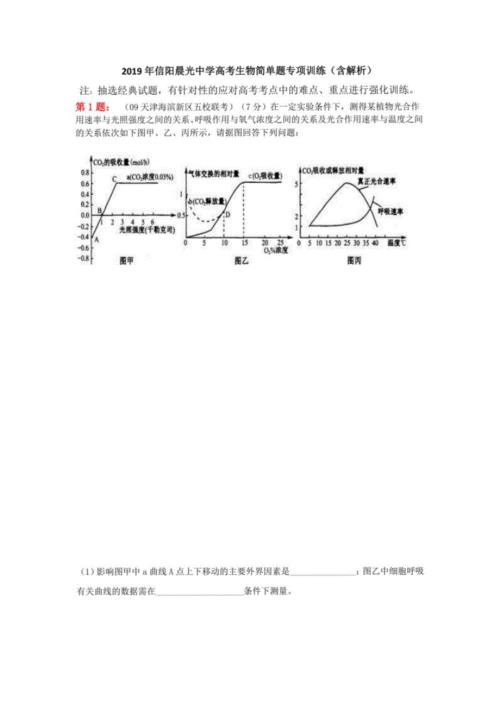
2019年信阳晨光中学高考生物简单题专项训练(含解析)

2018年一级建造师市政实务必考点

2019年和县第三中学高考生物简单题专项训练(含解析)

2018高考化学微题型微考点训练1--20

2019年大理市大理第二中学高考生物简单题专项训练(含解析)
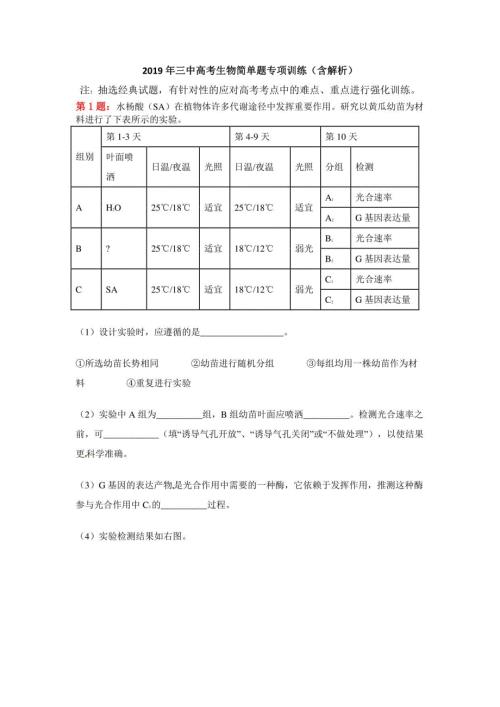
2019年三中高考生物简单题专项训练(含解析)

2018检验检测机构质量手册

2019年衡南县第三中学高考生物简单题专项训练(含解析)

2019年宏华中学高考生物简单题专项训练(含解析)

2018年银行从业资格考试个人贷款考点重点难点总结

2018全省行政执法资格模拟考试试题
 2024年中考英语复习现在进行时精讲&精讲(含答案)
2024年中考英语复习现在进行时精讲&精讲(含答案)
2024-04-30 8页
 2024年人教版英语中考一轮复习 八年级上册9-10单元 单词短语及考点清单(无答案)
2024年人教版英语中考一轮复习 八年级上册9-10单元 单词短语及考点清单(无答案)
2024-04-30 7页
 2024年中考英语复习名词的详细讲解和讲义(二)
2024年中考英语复习名词的详细讲解和讲义(二)
2024-04-30 7页
 2024年英语中考现在完成时的详细讲解和讲义
2024年英语中考现在完成时的详细讲解和讲义
2024-04-30 7页
 2024年英语中考数词的详细讲解和讲义
2024年英语中考数词的详细讲解和讲义
2024-04-30 6页
 2024年中考复习时态专项讲义(无答案)
2024年中考复习时态专项讲义(无答案)
2024-04-30 6页
 2024年牛津上海版中考英语语法专项句子的种类(无答案)
2024年牛津上海版中考英语语法专项句子的种类(无答案)
2024-04-30 9页
 2024年人教版中考英语两个基本语态(三)主动语态和被动语态讲义(完形填空和阅读理解练习)(含解析)
2024年人教版中考英语两个基本语态(三)主动语态和被动语态讲义(完形填空和阅读理解练习)(含解析)
2024-04-30 7页
 2024年中考英语语法一般现在时+知识点+练习(无答案)
2024年中考英语语法一般现在时+知识点+练习(无答案)
2024-04-30 7页
 2024届中考英语专项复习之定语从句的五大考点 讲义
2024届中考英语专项复习之定语从句的五大考点 讲义
2024-04-30 7页

