
2020年人教版化学选修三第二章 分子结构与性质 暑假测试卷含答案
10页1、绝密启用前2020年人教版化学选修三第二章 分子结构与性质 暑假测试卷本试卷分第卷和第卷两部分,共100分,考试时间150分钟。分卷I一、单选题(共15小题,每小题4.0分,共60分) 1.下列各组物质中,化学键全部为共价键的是()A NH4Cl、CO2、HClB O2、KF、SO2C HCl、CH3COOH、CH4D Na2O2、N2、H2O2.根据价层电子对互斥理论及原子的杂化轨道理论判断NF3分子的空间构型和中心原子的杂化方式为( )A 直线形sp杂化B 三角形sp2杂化C 三角锥型sp2杂化D 三角锥型sp3杂化3.以下有关杂化轨道的说法中错误的是()A 第A族元素成键时不可能有杂化轨道B 杂化轨道既可能形成键,也可能形成键C 孤电子对有可能参加杂化D s轨道和p轨道杂化不可能有sp4出现4.已知NN、N=N、NN键能之比为1.002.174.90,而CC,C=C,CC键能之比为1.001.172.34。下列有关叙述,不正确的是()A 乙烯分子中键、键的电子云形状对称性不同B 乙炔分子中键重叠程度比键小,易发生加成反应C 氮分子中的NN键非常牢固,不易发生加成反应D 氮气和乙炔
2、都易在空气中点燃燃烧5.下列有关性质的比较中,正确的是()A 微粒半径:O2FNaLiB 第一电离能:HeNeArC 分子中的键角:CH4H2OCO2D 共价键的键能:CCC=CCC6.卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX型卤素互化物与卤素单质的结构相似、性质相近。下图是部分卤素单质和XX型卤素互化物的沸点与其相对分子质量的关系图。试推测ICl的沸点所处的范围是在()A Cl2和BrCl之间B Br2和IBr之间C IBr和I2之间D BrCl和Br2之间7.关于CS2,SO2,NH3三种物质的说法中正确的是()A CS2在水中的溶解度很小,是由于其属于极性分子B SO2和NH3均易溶于水,原因之一是它们都是极性分子C CS2为非极性分子,所以在三种物质中熔、沸点最低D NH3在水中溶解度很大只是由于NH3分子有极性8.下列说法中不正确的是()A 所有含氢元素的化合物中都存在氢键,氢键是一种类似于共价键的化学键B 离子键、氢键、范德华力本质上都是静电作用C 只有电负性很大、半径很小的原子(如F、O、N)才能形成氢键D 氢键是一种分子间作用力,氢键比范德华力强9.
3、下列说法正确的是()A 已知NN键能为193kJmol1,故NN的键能之和为193kJmol13B HH键能为436.0kJmol1,FF键能为157kJmol1,故F2比H2稳定C 某元素原子最外层有1个电子,它跟卤素相结合时,所形成的化学键为离子键D NH键键能为390.8kJmol1,其含义为形成1mol NH所释放的能量为390.8kJ10.已知ZnCl42中Zn2+的4s轨道和4p轨道形成sp3型杂化轨道,则ZnCl42的空间构型为()A 直线形B 平面三角形C 平面正方形D 正四面体形11.下列说法中不正确的是()A 键比键重叠程度大,形成的共价键强B 两个原子之间形成共价键时,最多有一个键C 气体单质中,一定有键,可能有键D N2分子中有一个键,两个键12.下列物质中,既有共价键又有分子间作用力的是()A 氧化镁B 氦C 铜D 液氨13.关于键和键的比较,下列说法不正确的是()A 键是轴对称的,键是镜面对称的B 键是“头碰头”式重叠,键是“肩并肩”式重叠C 键不能断裂,键容易断裂D H原子只能形成键,O原子可以形成键和键14.下列模型分别表示C2H2、S8、SF6的结构,
4、下列说法正确的是()A 32 g S8分子中含有0.125 mol 键B SF6是由非极性键构成的分子C 1 mol C2H4分子中有5 mol 键和1 mol 键D C2H2分子中不含非极性键15.从键长的角度来判断下列共价键中最稳定的是()A HFB HNC HCD HS分卷II二、非选择题(共4小题,每小题10.0分,共40分) 16.比较下列化合物中共价键键长。(1)HF、HCl、HBr、HI(2)CO2、CS217.(1)硫化氢(H2S)分子中,两个HS键的夹角接近90,说明H2S分子的立体构型为_。(2)二硫化碳(CS2)分子中,两个C=S键的夹角是180,说明CS2分子的立体构型为_。(3)能说明CH4分子不是平面四边形,而是正四面体结构的是_(双选)。a两个键之间的夹角为10928bCH键为极性共价键c4个CH键的键能、键长都相等d二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)18.用价层电子对互斥模型预测下列粒子的立体结构。(1)H2Se(2)OF2(3)BCl3(4)PCl3(5)CO2(6)SO2(7)H3O(8)SO19.等电子体的结构相似、物理性质相近。
《2020年人教版化学选修三第二章 分子结构与性质 暑假测试卷含答案》由会员jinz****ang分享,可在线阅读,更多相关《2020年人教版化学选修三第二章 分子结构与性质 暑假测试卷含答案》请在金锄头文库上搜索。

鲁教版(五四制)七年级上册 1.2 图形的全等 学案(无答案)

鲁教版(五四制)七年级上册 1.3 探索三角形全等的条件(第三课时)学案(无答案)
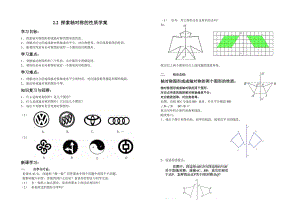
鲁教版(五四制)七年级上册2.2探索轴对称的性质学案(无答案)

鲁教版(五四制)七年级上册第一章 三角形章末复习学案(无答案)

鲁教版(五四制)七年级上册1.1认识三角形(第一课时)学案 (无答案)

鲁教版(五四制)七年级上册1.1认识三角形(第四课时)学案(无答案)

鲁教版(五四制)七年级上册1.1认识三角形(第三课时)学案(无答案)

鲁教版(五四制)七年级上册1.3探索三角形全等的条件(第二课时)学案(无答案)

鲁教版(五四制)七年级上册1.1认识三角形(第二课时)学案

鲁教版(五四制)七年级上册1.3探索三角形全等的条件(第一课时)学案(无答案)

鲁教版(五四制)七年级上册 1.1 认识三角形(第五课时)学案(无答案)

鲁教版(五四制)七年级上册1.4三角形的尺规作图学案(无答案)

鲁教版(五四制)七年级上册1.5利用三角形全等测距离学案(无答案)

鲁教版(五四制)七年级上册2.1轴对称现象学案(无答案)
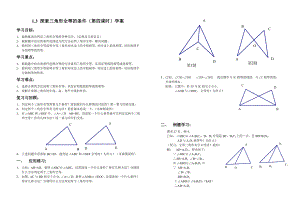
鲁教版(五四制)七年级上册1.3探索三角形全等的条件(第四课时)学案(无答案)

教师版-江苏省盱眙县实验中学苏科版九年级数学上册导学案(训练案)2.2-1圆的对称性

人教版初中化学讲义——16 第六单元 一氧化碳、二氧化碳、制取二氧化碳

教师版-江苏省盱眙县实验中学苏科版九年级数学上册导学案(训练案)2.7弧长及扇形的面积

人教版初中化学讲义——11化合价规律、相对分子质量、质量分数计算

高考 保分班话术
 2012年福建省仙游县初中第二教研片区期末联考七年级数学
2012年福建省仙游县初中第二教研片区期末联考七年级数学
2023-05-08 3页
 2013年七年级下册数学期末试卷
2013年七年级下册数学期末试卷
2022-09-12 4页
 四川省绵阳市高中2020届高考化学适应性考试四诊试题
四川省绵阳市高中2020届高考化学适应性考试四诊试题
2022-12-14 9页
 广东省惠州市惠东中学2015-2016学年高二数学上学期期中试题含解析
广东省惠州市惠东中学2015-2016学年高二数学上学期期中试题含解析
2023-01-13 16页
 2022年高三第二次质量检测 理科数学 含答案
2022年高三第二次质量检测 理科数学 含答案
2023-12-03 7页
 四川省眉山市彭山区第一中学2020-2021学年高二生物4月月考试题
四川省眉山市彭山区第一中学2020-2021学年高二生物4月月考试题
2024-03-14 6页
 贵州省2015年高考理综下学期第一次模拟考试题答案
贵州省2015年高考理综下学期第一次模拟考试题答案
2023-03-12 6页
 2022年高考英语一轮复习单元检测三十AnimalsinDanger外研版必修
2022年高考英语一轮复习单元检测三十AnimalsinDanger外研版必修
2023-04-26 3页
 2019-2020学年新教材高中地理第二章地球表面形态第一节流水地貌第2课时滑坡与泥石流练习湘教版必修第一册
2019-2020学年新教材高中地理第二章地球表面形态第一节流水地貌第2课时滑坡与泥石流练习湘教版必修第一册
2023-05-05 3页
 2013年高考物理模拟新题精选分类解析(第8期)专题19带电粒子在复合场中的运动
2013年高考物理模拟新题精选分类解析(第8期)专题19带电粒子在复合场中的运动
2023-06-26 19页

