
配合物稳定常数的测定
10页1、第七章 配合物稳定常数的测定配合物稳定常数是判断溶液中配合物稳定性的重要数据。早期的测定方法是:测得的是配合物的积累稳定常数实验方法上分:传统的方法有:1 电位法1) 电动势法2) pH电位法2 分光光度法3 溶剂萃取法4 离子交换法5 极谱法现代的方法:1 核磁共振法2 顺磁共振法3 折射法4 直接量热法5 测温滴定量热法数据处理方法上的进展:1 提出了测定稳定常数的比较普遍适用的数据处理方法2 计算机的引入,3 数学方法在测定稳定常数时的应用:1) 最小二乘法2) 加权最小二乘法测定的稳定常数一般为浓度稳定常数:在一定离子强度下的稳定常数,离子强度的支持电解质有:NaClO4KNO3NaNO3KClNaCl对于稳定常数大者,采用较小的离子强度对于稳定常数小者,采用较大的离子强度实验方法上分:A 直接测出参与某一反应的物种的平衡浓度,pH电位法,电动势法,极谱法,溶剂萃取法,离子交换法。B 测出体系的物理化学性质来间接求出各物种的浓度,如光密度(分光光度法),量热法等。本课程主要介绍电动势法和pH电位法。第一节 用于测定配离子稳定常数时的函数用有关的实验方法测定配离子的稳定常数时,将
2、有关数据,通过适当的函数,与待求的稳定常数联系起来,经过一定的数据处理,有图解或计算可求出稳定常数。1 Fronaeus函数 Fronaeus函数又称为成配度,和前面的副反应系数M的形式是一样的,通常用Y0表示:Y0 即M对于形成配合物的体系,因有:MiL=MLIMLI=IMLI而MT=Y0=1+Y0仅仅是游离配体浓度L的函数。2 生成函数(Bjerrum函数)生成函数表示已与中心离子M配位的配体数目的平均值。对于M与配体L形成单核配离子体系来说,已与中心离子配位的配体的总浓度为:ML+2ML2+3ML3+.+nMLn,中心离子的总浓度为MT, 则有:将有关稳定常数的表达式代入,则有:小结:生成函数只是L的函数。实际上与金属离子配位的配体的浓度由下式表达:1 L不加质子的情况LT=L+即分子LTL2 L可加质子的情况LT=L+即分子LTL 将有关L的加质子常数代入后有:LTL (1)函数Y0和是在电子计算机处理配离子的稳定常数之前提出的,而在后来的计算机处理法中仍然采用这两函数。第二节 Fronaeus函数和生成函数的应用理论上利用这两个函数,通过曲线拟合可以求出配合物的稳定常数,或通
3、过实验点可以求出(n个稳定常数,有n个点,建立n个方程)1 Leden法Leden提出了一个与Fronaeus函数极相似的函数,一般又称为Leden函数:Y0=1+令Y1Y1即称为Leden函数,实际上Y1也是L的函数。方法:1) 实验求出Y0和L2)求出Y13) 以Y1对L作图4) 在Y1L图上有一段直线,在这段直线中: 截距1 斜率2 5) 求出1后,再造一函数Y2, 6) 以Y2对L作图,在直线部分求得斜率3和截距22 徐光宪法通过Y值的对数(lgY)与配体的浓度L作图,取直线部分的数据,其截距为lg 即有:lgYj=lgj +bL两边取对数:当很小时,高阶的可以忽略,即 在一定范围内,可以用下式表达:bL即lgY1=lg1 +bL同理,有:lgYj=lgj +bL用Fronaeus函数和生成函数进行数据处理时,在求出Y的过程中,即要知道M又要知道L,这两种数据都必须由实验测得。如配体不加质子,且有LTMT时,可用LT代替L在配体加合质子的情况下,由已知LT条件下测定pH, 由pH的关系:LT=L+L LT/(1)如果LT不是比MT大很多,则仍可以采用上述方法处理,求出近似的Y1
《配合物稳定常数的测定》由会员简****9分享,可在线阅读,更多相关《配合物稳定常数的测定》请在金锄头文库上搜索。

2019年自贡市清华园学校高考生物简单题专项训练(含解析)

2019年秋季石油大学现代应用文写作网考练习试题+在线作业答案

2019年信宏中学高考生物简单题专项训练(含解析)

2019年莲塘中学高考生物简单题专项训练(含解析)

2019年宜阳县二中高考生物简单题专项训练(含解析)

2019年宁波神舟学校高考生物简单题专项训练(含解析)

2019年谢通门县中学高考生物简单题专项训练(含解析)

2019年前埔中学高考生物简单题专项训练(含解析)

2018年二级建造师公路工程实务重点考点总结

2018年一级建造师水利水电实务考点重点

2019年一级建造师市政实务案例考点

概率论与数理统计第二版谢永钦课后答案

空间向量求角度与距离10种题型归类 (解析版)2023-2024学年高二数学上学期期中期末复习讲练测(人教A版2019选择性必修第一册)

中医综合模拟试卷348

2011年3000名教师及特岗招考《计算机基础》复习题
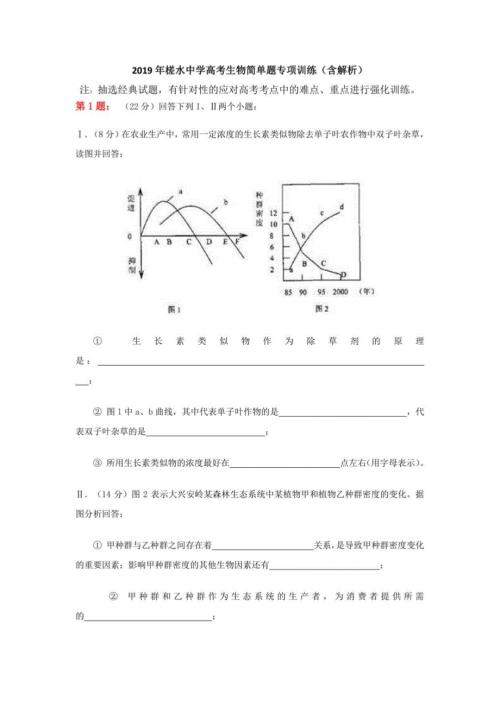
2019年槎水中学高考生物简单题专项训练(含解析)

2009年9 月全国计算机等级考试二级笔试试卷

2019年宣城市第四中学高考生物简单题专项训练(含解析)

中医综合模拟试卷333

2019年安全知识竞赛题库2
 09.石油公司制度体系诊断及优化咨询项目
09.石油公司制度体系诊断及优化咨询项目
2024-04-08 33页
 职工教育培训经费管理办法(规模生产制造业版)
职工教育培训经费管理办法(规模生产制造业版)
2024-04-08 10页
 08.圆通银行战略咨询项目
08.圆通银行战略咨询项目
2024-04-08 25页
 企业培训费管理实施暂行细则
企业培训费管理实施暂行细则
2024-04-08 12页
 职工教育培训经费管理办法(适合中小企业)
职工教育培训经费管理办法(适合中小企业)
2024-04-08 10页
 企业规章制度框架体系管理规定(2024修订版)
企业规章制度框架体系管理规定(2024修订版)
2024-04-08 21页
 05.景宏集团全面管理提升咨询项目
05.景宏集团全面管理提升咨询项目
2024-04-08 40页
 07.玉兔食品集团供应链咨询项目
07.玉兔食品集团供应链咨询项目
2024-04-08 34页
 04.大华乳业业务战略咨询项目
04.大华乳业业务战略咨询项目
2024-04-08 28页
 06.德邦公司精益生产管理咨询项目
06.德邦公司精益生产管理咨询项目
2024-04-08 28页

