
USP〈1225〉药典规程的验证(中英文对照).pdf
19页1、VALIDATION OF COMPENDIAL PROCEDURES 药典药典规程规程的验证的验证 Test procedures for assessment of the quality levels of pharmaceutical articles are subject to various requirements According to Section 501 of the Federal Food Drug and Cosmetic Act assays and specifications in monographs of the United States Pharmacopeia and the National Formulary constitute legal standards The Current Good Manufacturing Practice regulations 21 CFR 211 194 a require that test methods which are used for assessing compliance of
2、pharmaceutical articles with established specifications must meet proper standards of accuracy and reliability Also according to these regulations 21 CFR 211 194 a 2 users of analytical methods described in USP NF are not required to validate the accuracy and reliability of these methods but merely verify their suitability under actual conditions of use Recognizing the legal status of USP and NF standards it is essential therefore that proposal for adoption of new or revised compendial analytica
3、l procedures be supported by sufficient laboratory data to document their validity 用于评价药物质量水平的测试规程受到多种要求的影响 根据联邦食品 药物 化妆品法案 501 款 在美国药典和国家处方集的各论中的含量测定和质量标准构成了法定标准 现行药品 优良生产规范 21 CFR 211 194 a 要求 用于评价药物与既有质量标准之间的符合性的分析 规程必须在准确度和可靠性方面达到适当的标准 并且根据这些法规 21 CFR 211 194 a 2 在 USP NF 中描述的分析规程的使用者无需验证这些规程的准确度和可靠性 而仅需确认其在 实际使用条件下的适用性 认识到 USP 和 NF 标准的法律地位 因此 提议采纳新的或更改 过的药典分析规程时 以充分的实验室数据作为支持 以记录其有效性 成为基本要求 The text of this information chapter harmonizes to the extent possible with the Tripartite Internatio
4、nal Conference on Harmonization ICH documents Validation of Analytical Procedures and the Methodology extension text which are concerned with analytical procedures included as part of registration applications submitted within the EC Japan and the USA 本信息章节的内容尽可能地与三方国际协调会议 ICH 文件分析规程的验证和方法学的延伸 内容保持一致 ICH 的内容关注的是作为在欧盟 日本 美国提交注册申请的一部分的分析规 程 SUBMISSIONS TO THE COMPENDIA 向药典提交向药典提交的文件的文件 Submissions to the compendia for new or revised analytical procedures should contain sufficient information to en
5、able members of the USP Council of Experts and its Expert Committees to evaluate the relative merit of proposed procedures In most cases evaluations involve assessment of the clarity and completeness of the description of the analytical procedures determination of the need for the procedures and documentation that they have been appropriately validated Information may vary depending upon the type of method involved However in most cases a submission will consist of the following sections 向药典提交关于
《USP〈1225〉药典规程的验证(中英文对照).pdf》由会员飞****9分享,可在线阅读,更多相关《USP〈1225〉药典规程的验证(中英文对照).pdf》请在金锄头文库上搜索。

第三单元 秦汉时期:统一多民族国家的建立和巩固(单元复习好卷)

七年级历史阶段性学业水平测试

《论语》十二章全面解读

Web前端开发案例教程:12完整项目化妆品网站设计与实现

编程基础与实例教程-PHP

2019年抚顺市第六中学高考生物简单题专项训练(含解析)

2019年教科版八年级物理上册全册学案

2019年宝鸡晨光中学高考生物简单题专项训练(含解析)

2019年象山港书院高考生物简单题专项训练(含解析)

2019年一级建造师工程经济考点总结

2019年小学教育教学工作总结4篇

2019年浙江省金华市中考数学试卷(解析版)
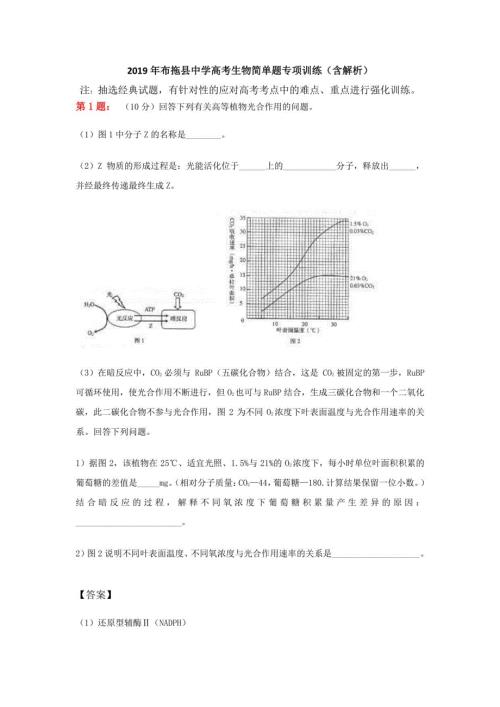
2019年布拖县中学高考生物简单题专项训练(含解析)

2010年卫生系列中级职称内科学风湿及结缔组织病习题及参考答案
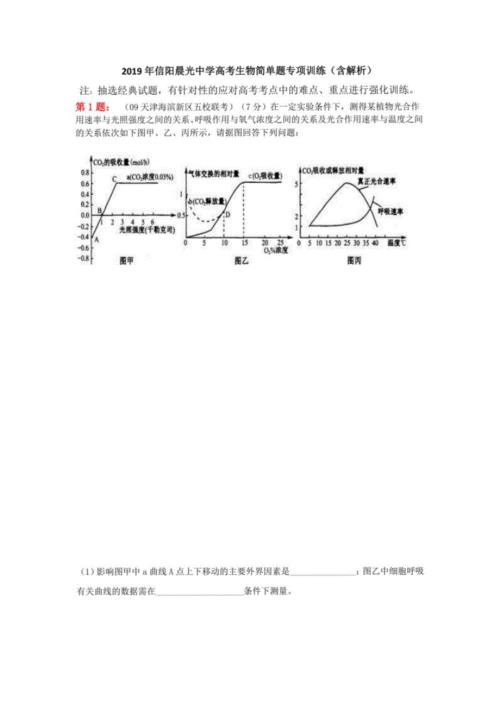
2019年信阳晨光中学高考生物简单题专项训练(含解析)

2018年一级建造师市政实务必考点

2019年和县第三中学高考生物简单题专项训练(含解析)

2018高考化学微题型微考点训练1--20

2019年大理市大理第二中学高考生物简单题专项训练(含解析)
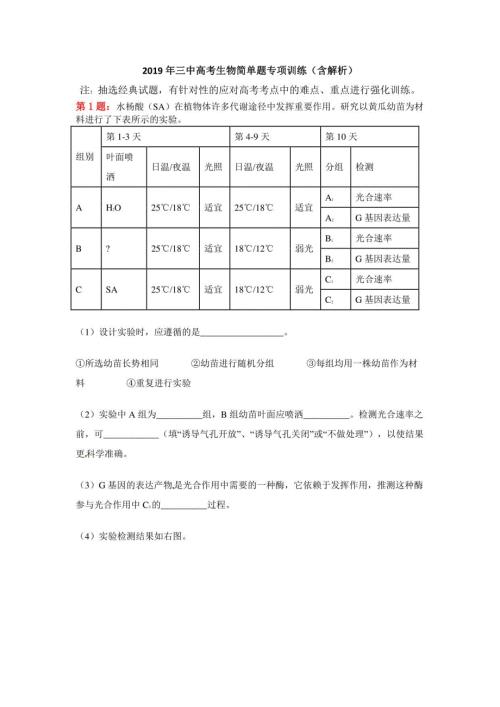
2019年三中高考生物简单题专项训练(含解析)
 云南洱海流域水污染
云南洱海流域水污染
2022-11-20 43页
 电大考试题及答案社会政策本科名词解释
电大考试题及答案社会政策本科名词解释
2022-07-26 8页
 酒店第三季度工作计划2019与酒店第二季度工作总结汇编.doc
酒店第三季度工作计划2019与酒店第二季度工作总结汇编.doc
2023-09-24 19页
 优选资料:全市2020年度党风政风监督工作要点.docx
优选资料:全市2020年度党风政风监督工作要点.docx
2024-01-30 8页
 小学生100以内口算题卡A4打印版3000道.doc
小学生100以内口算题卡A4打印版3000道.doc
2022-12-20 30页
 大学英语作文高级词汇
大学英语作文高级词汇
2023-06-08 3页
 私募基金公司全套制度--对外担保制度
私募基金公司全套制度--对外担保制度
2023-08-14 5页
 一年级学生听课习惯的研究
一年级学生听课习惯的研究
2023-04-09 10页
 酒店保安工作范文
酒店保安工作范文
2023-12-02 5页
 职业生涯规划书面报告
职业生涯规划书面报告
2024-01-07 33页

