
详解仿制药研发具体流程
16页1、WORD格式整理分享详解仿制药研发具体流程目录一、综述2二、仿制药研发项目汇总3三、仿制药的研发具体步骤:5(一)产品信息调研5(二)前期准备(约一个月完成):51、参比制剂的采购52、原料采购53、色谱柱及对照品采购54、辅料采购:65、包材的采购:6(三)处方工艺研究61、原辅料及参比制剂的检验62、处方工艺摸索63、初步验证工艺84、中试生产及工艺验证8(四)质量研究91、质量研究项目的选择及方法初步确定 92、质量标准的方法学验证103、质量对比研究124、质量标准的制定14(五)稳定性研究(中试产品)14专业资料(六)药理毒理研究16(七)申报资料的撰写、整理16(八)申报临床及申报现场核查17(九)临床研究17(十)申报生产17一、综述根据药品注册管理办法附件二的规定,仿制药即是已有国家药品标准的原料 药或者制剂,该类药物国内已批准生产或上市销售, 经过国内外广泛使用,其安 全性、有效性已经得到较充分证实。如今的新法规对仿制药提出了新的要求,主要是以下几点:1、规范对被仿制药品的选择原则,即参比制剂的选择问题。2、增加批准前生产现场的检查。3、按照CTD格式要求提供申报资料
2、,使申报规范,统一。4、强调了对比研究,是判断两者质量是否一致的重要方法之一。5、强化了工艺验证,目的是确保大生产时能始终如一地按照申报工艺生产 出质量恒定的产品。&提出了晶型的要求,晶型的不同,溶解度和稳定性不同。分析上述新要求和参考指导原则,从而得出结论:仿制药研发的目的是做到规模化生产,强调本地化,以实现“替代性”。要 求是做到“同”。方法为对比研究。1. 安全性“同”:对于安全性,口服固体制剂控制的主要为有关物质, 而液体制剂除控制有关 物质外,还需对防腐剂、氧化剂等对人体有影响的物质进行控制。因此,必须要 将防腐剂含量测定定入质量标准。研究的内容:静态上应包括杂质谱的对比,单个杂质的对比,杂质总量的对 比。动态上的对比为影响因素试验、加速试验的对比,即稳定性对比研究。2. 有效性“同”:对于口服固体制剂,口服混悬剂(包括干混悬剂),溶出曲线是主要的控制指 标1;对于口服溶液剂,防腐剂、矫味剂、氧化剂、增溶剂及稳定剂的选用非常 重要,控制点为口感、渗透压、PH及有无絮凝现象;对于局部用制剂(如鼻喷雾 剂),粒度分布、渗透压及黏度是主要控制指标。研究的内容:分别进行溶出曲线对比;
3、粒度分布对比;渗透压及黏度对比。3. 晶型:晶型的不同,药物的溶解度及稳定性有可能不相同, 从而导致生物利用度不 尽相同。而某个药物的晶型,文献资料很少;制剂中原料的晶型测定有一定的难 度;在做成制剂的过程中,又不能保证晶型不产生变化。但是,鉴于仿制药研究的特点,溶解度方面可通过溶出曲线对比来说明;稳定性方面可通过影响因素试验和加速试验的对比来说明。仿制药研发项目汇总(从立项到申报,时间为1012个月)项目项目内容所需时间(一)产品信息调研质量标准、工艺处方等-周(二)前期准备1、参比制剂的采购2、原料采购3、色谱柱及对照品采购4、辅料采购5、包材的采购(可放置中试之前)一个月(三)处方工艺研究1、原辅料及参比制剂的检验2、处方工艺摸索2.1辅料相容性试验2.2处方筛选3、初步验证工艺3.1 三批小试3.2 样品检验3.3 确定处方工艺。4、中试生产及工艺验证4.1 中试批量4.2 中试生产4.3 工艺验证一周两个月半个月半个月(四)质量研究1、质量研究项目的选择及方法初步确定2、质量标准的方法学验证一周中试产品2.1 质量标准的初步验证(在中试之前)2.2 系统的方法学验证(中试产品
4、)3、质量对比研究4、质量标准的制定后一个月一个月(五)稳定性研究1、影响因素试验2、加速试验3、长期试验4、中间条件试验5、稳定性研究结果的评价 另:包材相容性试验半个月 与加速及 长期同步6个月6个月(六)药理毒理研究1、药理毒理资料进行整理归纳总结2、试验委托资料整理时用中试产品(七)申报资料的撰写、整 理1、综述资料3、药学研究资料3、药理毒理研究资料4、临床试验资料稳定性试 验完成后 1个月内(八)申报现场核查1、将资料和电子申报表报省局,准备现场核查。2、动态三批现场工艺核查,抽样送检省药检所复 检。一个月(九)临床研究1、固体口服制剂做生物等效性2、溶液剂一般可免临床3、局部用制剂一般需做临床试验(十)申报生产临床试验完成后,整理资料,申报省局。一至两个 月三、仿制药的研发具体步骤:(一)产品信息调研(约一周完成)是否有合法原料提供;临床资料、不良反应资料及产品说明书等相关资料 ; 国内及进口制剂剂型及规格;产品质量标准(原研标准、国内首仿标准、药典标准); 原研处方组成及工艺研究资料;药品的稳定性资料;专利情况;生产注册情况(产 品原研厂家、国内生产申报厂家数情况);参
《详解仿制药研发具体流程》由会员汽***分享,可在线阅读,更多相关《详解仿制药研发具体流程》请在金锄头文库上搜索。

房地产公司出纳职责(2篇).doc

普陀最好的补习班英语倒装习题

桥梁工程施工组织设计方案报审表5

推荐音乐教学总结汇总十篇

小学语文教学反思螳螂捕蝉反思
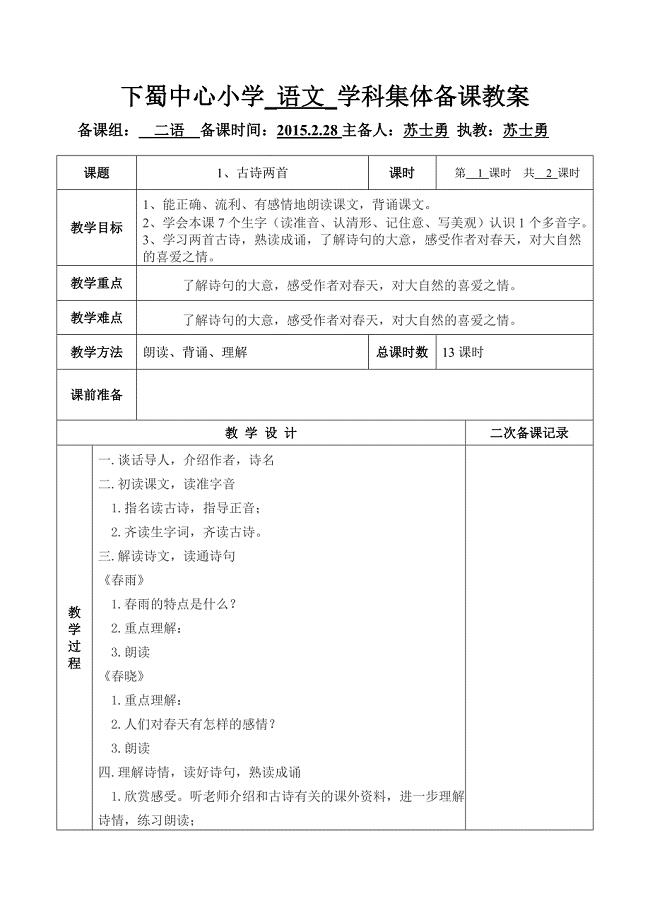
1、古诗两首第一课时

安徽政治解析

老师入职培训情况的个人心得范文3篇(入职培训的心得体会范文)

网页兼职编辑中文求职信

销售个人年度工作计划 2

餐饮店铺租赁合同电子版(八篇).doc

营销方案范文汇总7篇(可编辑)

项目部安全管理制度范文(五篇).doc

海洋石油平台的防腐蚀

晋城隔膜技术应用项目商业计划书

中班的班主任工作计划样本(4篇).doc

大学英语四级一意多词周易

2022年仓管转正工作总结

浙江省嘉兴市海宁市2013年高三语文测试及答案
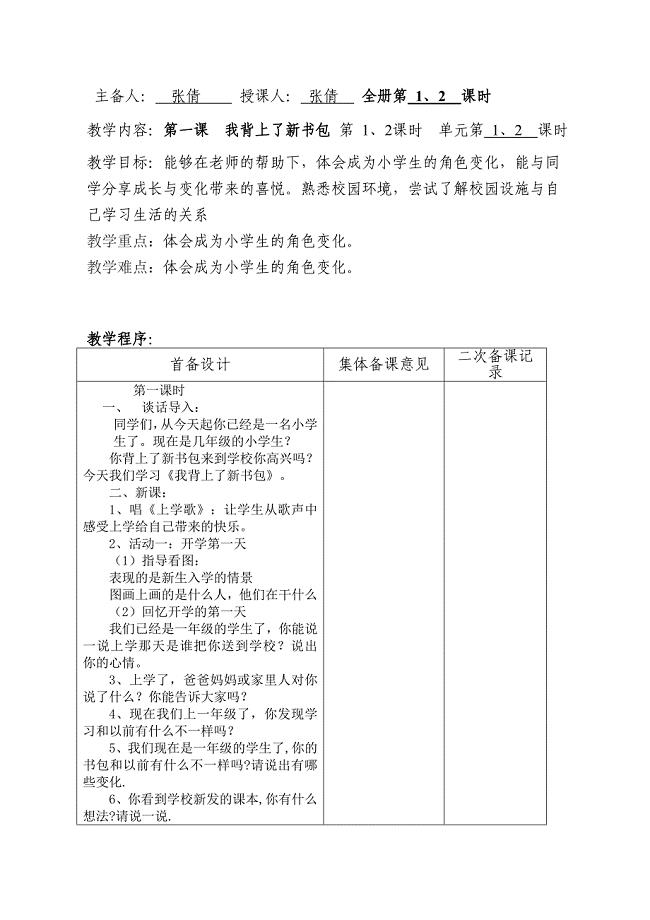
一年级思想品德教案
 消防连廊专项施工方案修改
消防连廊专项施工方案修改
2024-02-25 33页
 【最新】七年级地理上册3.1世界的人口学案2新版湘教版6
【最新】七年级地理上册3.1世界的人口学案2新版湘教版6
2022-11-12 2页
 安全技术资料台帐之十二
安全技术资料台帐之十二
2022-10-04 79页
 农村行政管理实训
农村行政管理实训
2023-11-16 32页
 新项目量产管理规定
新项目量产管理规定
2023-05-31 5页
 公共卫生医疗救治中心施工组织设计
公共卫生医疗救治中心施工组织设计
2023-09-02 116页
 最新高中数学广东省汕头市金山中学高三上学期摸底考试理科数学试卷含答案
最新高中数学广东省汕头市金山中学高三上学期摸底考试理科数学试卷含答案
2024-03-04 10页
 湖南省师大附中高三第六次月考文科综合试题
湖南省师大附中高三第六次月考文科综合试题
2023-08-19 23页
 电网公司表彰奖励工作管理办法
电网公司表彰奖励工作管理办法
2023-06-28 14页
 某酒店弱电智能化系统设计方案06.背景音乐及紧急广播系统方案
某酒店弱电智能化系统设计方案06.背景音乐及紧急广播系统方案
2022-08-31 8页

