
2016九年级.化学下册第九单元课题2溶解度导学案(新解读
9页1、第九单元 溶液 课题2 溶解度知识点1:饱和溶液和不饱和溶液1.饱和溶液与不饱和溶液的定义在一定温度下,在一定量的溶剂里,不能继续溶解某种溶质的溶液,叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。2.判断溶液是否饱和的方法一般地说,要确定某一溶液是否饱和,只要看在一定温度下,有没有不能继续溶解的剩余溶质存在,如果有,且溶质的量不再减少,那么这种溶液就是所对应温度下的饱和溶液。因此,判断一种溶液是否为饱和溶液,可在温度和溶剂量不变的条件下,向原溶液中再加入少量原溶质,如果溶质不再溶解,说明原溶液是饱和溶液;如果溶质继续溶解,说明原溶液是不饱和溶液。拓展延伸饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系。(1)浓溶液、稀溶液的定义:为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里,含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。(2)饱和溶液、不饱和溶液与浓溶液、稀溶液是从两个不同角度对溶液进行分类的,因此两组概念之间没有必然的联系,即饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。但是,在一定温度下,同一溶质的
2、饱和溶液比它的不饱和溶液要浓。【例】周末,感到有点饿的甲同学泡了一杯白糖开水,他用筷子充分搅拌杯中的白糖后,将杯子放在一边待糖水变凉,喝糖水时,发现杯底有少量未溶解的白糖(如图1)。下列操作或现象能说明糖水一定属于饱和溶液的是()图1A.泡糖水时进行了充分搅拌 B.糖水热的时候白糖全部溶解C.凉的糖水底部有剩余的白糖 D.喝糖水时感到很甜答案:C点拨:甲同学泡了一杯白糖开水,他用筷子充分搅拌杯中的白糖后所得的溶液没说是否有不溶物,所以不一定饱和,故A错;糖水热的时候白糖全部溶解,可能刚好饱和,也可能不饱和,故B错;待糖水变凉,喝糖水时,发现杯底有少量未溶解的白糖,说明此时属于饱和溶液,故C正确;喝糖水时感到很甜与浓度有关,与是否饱和无关,故D错。知识点2:饱和溶液和不饱和溶液的转化条件1.大多数物质(如KNO3等)的饱和溶液与不饱和溶液之间的转化可通过如下方法:饱和溶液 不饱和溶液2.极少数物质如Ca(OH)2的饱和溶液与不饱和溶液之间的转化需通过如下方法:饱和溶液 不饱和溶液易错警示对于不同溶质的溶液而言,改变溶质、溶剂的量都可以实现上述转变,但改变温度要视具体物质而定,如KNO3等
3、大多数固体物质的溶解能力随温度的升高而增大,但有极少数固体物质(如氢氧化钙)的溶解能力随温度的升高而减小,因此若将KNO3的不饱和溶液转化为饱和溶液应降低温度,若将Ca(OH)2的不饱和溶液转化为饱和溶液应升高温度。【例】欲使任意一种不饱和溶液转变为饱和溶液,最可靠的方法是()A.升高温度 B.降低温度 C.再加入同种溶质 D.倒出一些溶液答案:C点拨:因为不同物质的溶解能力受温度变化的影响不同,因此,升高温度或降低温度不一定能使不饱和溶液转变为饱和溶液,故A、B错误;溶液具有均一性、稳定性,因此倒出一些溶液不能将不饱和溶液转变为饱和溶液,故D错误;而加入同种溶质一定能将不饱和溶液转变为饱和溶液,因此最可靠的方法是加入同种溶质,故C正确。知识点3:固体物质的溶解度1.固体物质的溶解度(1)概念:在一定温度下,某固态物质在100 g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。(2)正确理解概念中的四要素(见表1)。表1四要素条件标准状态单位内容在一定温度下在100 g溶剂里达到饱和状态g理解影响固体物质溶解度的内因是溶质和溶剂的性质,外因是温度。如果温度改变,则固
4、体物质的溶解度也会改变,因此,只有在指明温度时,溶解度才有意义为了比较不同物质的溶解能力,人们规定以100 g溶剂为标准,需强调和注意的是:此处100 g是溶剂的质量,而不是溶液的质量溶解度是比较同一条件下某种物质溶解能力大小的表示方法,只有达到该条件下溶解的最大值,才可称其为溶解度,因此必须要求“达到饱和状态”溶解度是规定标准下的溶质的质量,常用单位“g”来表示2.影响固体物质溶解度的因素(1)内部因素:溶质和溶剂本身的性质。例如20 时,KNO3的溶解度为31.6 g,氯化钠的溶解度为36 g,此处造成溶解度不同的原因是硝酸钾与氯化钠两种溶质的性质不同。20 时KNO3在水中、汽油中的溶解度相差很大,这是由于溶剂性质不同的原因。(2)外部因素:温度。与溶剂量的多少没有关系,因为概念已经规定溶剂质量为100 g,所以固体物质的溶解度只随温度的变化而变化。易错警示溶解度概念中的四个要素“一定温度、100 g溶剂、饱和状态、溶解的质量”是同时存在的,只有四个要素都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也不正确。这也是判断某一有关溶解度说法正确与否的关键。【例】“1
《2016九年级.化学下册第九单元课题2溶解度导学案(新解读》由会员不***分享,可在线阅读,更多相关《2016九年级.化学下册第九单元课题2溶解度导学案(新解读》请在金锄头文库上搜索。
![电力设备预防性试验规章制度[2017年]](https://union.02img.goldhoe.com/2019-11/16/4667be4f-7732-484e-a02e-4246affcb5f8/pic1.jpg)
电力设备预防性试验规章制度[2017年]

电力设备预防性试验规章制度(2016)

电力设备销售技巧大全

电力行业项目工程设计资质分级

电力管线施工专项计划方针
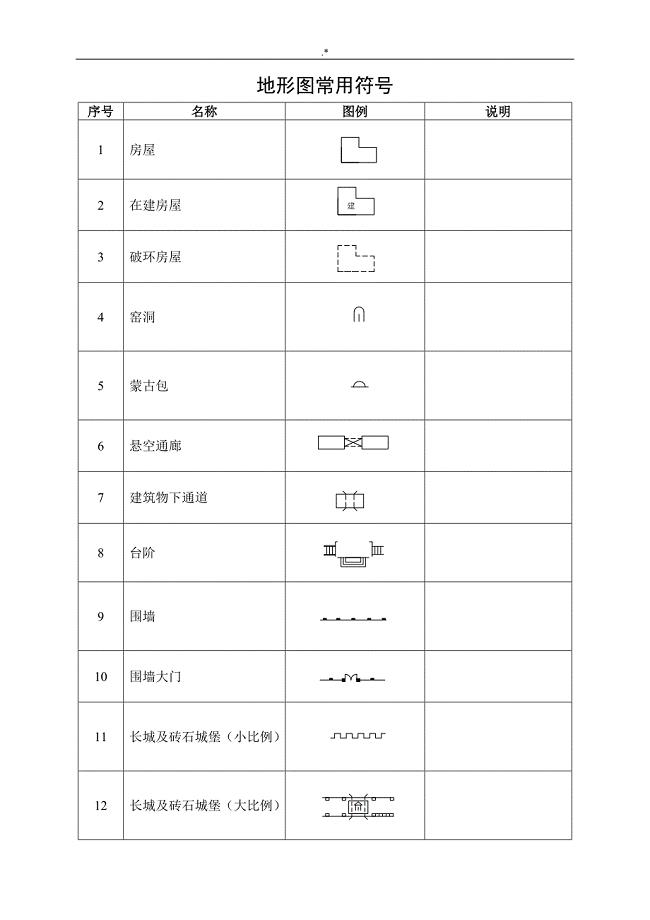
地形图普通符号(整编汇总)

地坪拆除修复施工方案方针

SL223-2008水利水电建设项目工程验收规章制度

RBT214-2017检验检测机构通常要求新编内审检查表

QUIC协议合约介绍

钢材采购招投标材料

风冷模块维护介绍资料

风控介绍资料(定版)

风景园林项目工程试题及其答案解析

电力设备采购合同协议文本范文样式(最佳)

电力设备安装项目工程投标书

电力三级及其以上施工安全风险识别,评估和预控清册

电力浅沟专项施工方案方针

电力设备交接和预防性试验规章制度

2017新课标全国卷3语文试题及其答案解析
 医用高等数学课件4-导数与中值定理练习-答案-(2012)
医用高等数学课件4-导数与中值定理练习-答案-(2012)
2023-02-28 2页
 共产党宣言稿子
共产党宣言稿子
2022-11-14 8页
 社会学概论00034密训资料(最新版)
社会学概论00034密训资料(最新版)
2022-11-08 12页
 马克思主义基本原理概论03709密训资料
马克思主义基本原理概论03709密训资料
2022-11-09 12页
 社会学概论00034考前资料
社会学概论00034考前资料
2022-11-08 16页
 社会学概论00034主观题汇总
社会学概论00034主观题汇总
2022-11-08 17页
 马克思主义基本原理概论03709主观题汇总
马克思主义基本原理概论03709主观题汇总
2022-11-08 15页
 英语(二)必备词汇表-4500单词
英语(二)必备词汇表-4500单词
2022-11-02 39页
 领导科学00320主观题汇总(最新版)
领导科学00320主观题汇总(最新版)
2022-11-02 17页
 行政管理学00277密训资料(最新版)
行政管理学00277密训资料(最新版)
2022-11-02 12页

