
高考化学一轮总复习:第1讲 物质的量
43页1、第1讲 物质的量,高考化学一轮复习,考点突破,考点一 以物质的量为核心的有关计算,考点三 摩尔质量的几种计算方法,考点二 阿伏加德罗常数,1.基本公式 (1)物质的量(n)、微粒数(N)、物质的质量(m)之间的换算 =n(mol) = 以上计算公式适用于任何条件下的任何物质。 (2)物质的量(n)、气体体积(V)之间的换算 特别提示 任何状况下的任何气体均存在Vm。,考点一 以物质的量为核心的有关计算,标准状况(0 、101 kPa)下,Vm=22.4 Lmol-1。 上述计算公式只适用于气体,在标准状况下,H2O、SO3、苯、己烷等 均不是气体。 2.依据化学方程式计算的基本原理和解题步骤 (1)基本原理 N2 + 3H2 2NH3 物质的质量之比 28 6 34 物质的量之比 1 3 2 气体体积之比 1 3 2 物质的分子数之比 1 3 2,(2)解题步骤,3.差量法在化学方程式的有关计算中的应用 (1)差量法的应用原理 差量法是指根据化学反应前后物质量的变化,找出“理论差量”,然后根据已知条件列比例式求解。这种差量可以是质量、物质的量、气态物质的体积。 (2)使用差量法的注意事
2、项 有关物质的物理量及其单位都要正确使用,即“上下一致,左右相当”。,典例1 设NA为阿伏加德罗常数的值,如果a g某气态双原子分子的分子 数为p,则b g该气体在标准状况下的体积V(L)是 ( ) A. B. C. D.,D,答案 D 解法一 公式法,解法二 比例法 同种气体其分子数与质量成正比,设b g气体的分子数为N,则N= ,b g该 气态双原子分子的物质的量为 mol,所以b g该气体在标准状况下的,体积为 L。,1-1 已知Q与R的摩尔质量之比为922,在反应X+2Y 2Q+R中,当 1.6 g X和Y完全反应后生成4.4 g R,则参与反应的Y和生成物Q的质量 之比为 ( ) A.469 B.329 C.239 D.169,D,答案 D 应用化学方程式中各物质的化学计量数之比等于变化的物质 的量之比可得 。根据质量守恒定律得m(Y)=4.4 g+3.6 g-1.6 g=6.4 g。m(Y)m(Q)=6.4 g3.6 g=169。,1-2 为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品 加热,其质量变为w2 g,则该样品的纯度(质量分数)是 ( )
3、,A,答案 A 解法一 差量法。 设样品中含NaHCO3 x g,则 2NaHCO3 Na2CO3+CO2+H2O m 284 62 x w1-w2 x= 则Na2CO3的质量分数为 。,解法二 设样品中有x mol NaHCO3,则: 2NaHCO3 Na2CO3+CO2+H2O x mol 0.5x mol 据样品加热前后固体质量的关系,有w1 g-x mol84 g mol-1+0.5x mol10 6 g mol-1=w2 g,解得x= ,m(NaHCO3)= mol84 g mol-1= ,从而推知样品中m(Na2CO3)= ,因此Na2CO3样品的纯度(Na2CO3)= = 。,“设NA为阿伏加德罗常数的值。下列说法(不)正确的是”是高考的常见考查形式。本考点主要围绕以下几个方面进行考查: 1.已知物质的质量来求微粒的数目 主要应用N= NA来计算,解答此类题应注意看清所求微粒的种类,分子的构成(是单原子分子,还是双原子分子或多原子分子)以及微粒中含有的质子数、中子数、电子数等。 例如:常温、常压下,14 g由N2与CO组成的混合气体中含有的原子数目为 NA,这一说法是否正
4、确?,考点二 阿伏加德罗常数,由于二者的摩尔质量相同,所以质量一定时,二者无论以何种比例混合 都不影响分子总数,故这一说法是正确的。 2.已知气体的体积来求微粒的数目 主要应用N= NA来计算,解题时要注意: (1)若题目给出物质的体积,一要看是否是标准状况,若不是标准状况,则1 mol气体的体积一般不为22.4 L;二要看该物质在标准状况下是不是气体,若不是气体,则无法求其物质的量和分子数目;若是气体,则可求其物质的量和分子数目,这与其是混合气体还是单一气体无关。,此题包含以下信息:,在标准状况下,SO3是固体,水、乙醇、CCl4及碳原子数大于4而小于16的烃 呈液态。 例如:常温常压下,22.4 L NO2和CO2的混合气体中含有2NA个氧原子,这一说 法是否正确? 解答此题时要注意常温常压下的气体摩尔体积大于22.4 Lmol-1,此时22.4 L混合气体的物质的量小于1 mol,则氧原子数目也小于2NA,故这一说法不正 确。 (2)若题目给出气体的质量或物质的量,则微粒数目与外界条件无关。 (3)注意某些物质分子中的原子个数。例如稀有气体为单原子分子,臭氧(O3)为三原子分子,
《高考化学一轮总复习:第1讲 物质的量》由会员hu****a8分享,可在线阅读,更多相关《高考化学一轮总复习:第1讲 物质的量》请在金锄头文库上搜索。

小学班级公约背景模版

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
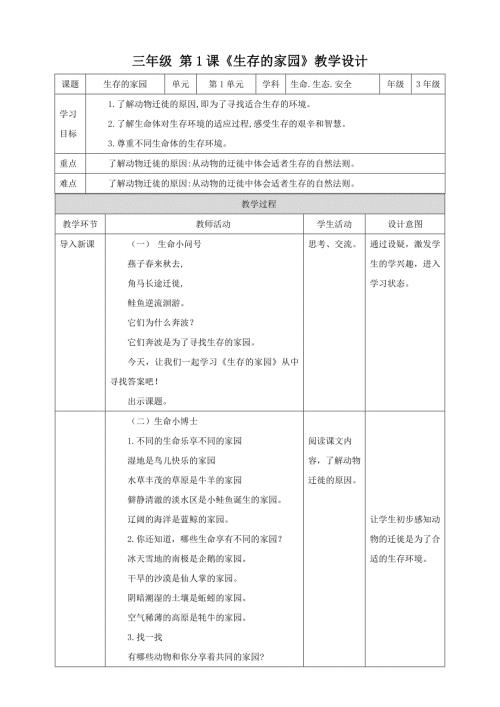
第1课《生存的家园》教学设计
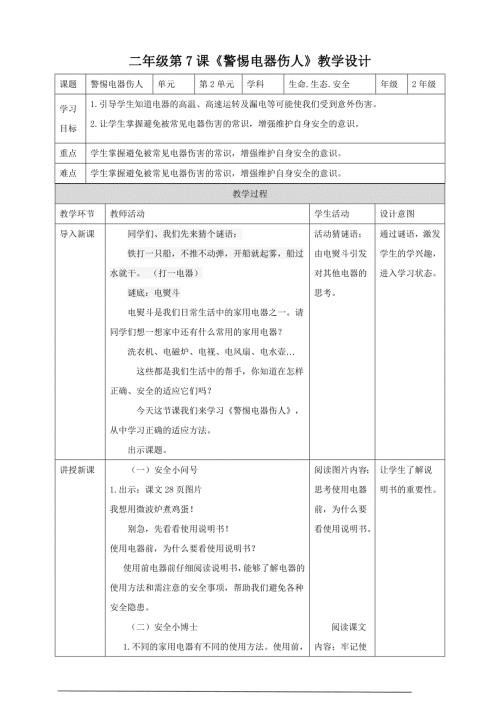
第7课《警惕电器伤人》教学设计
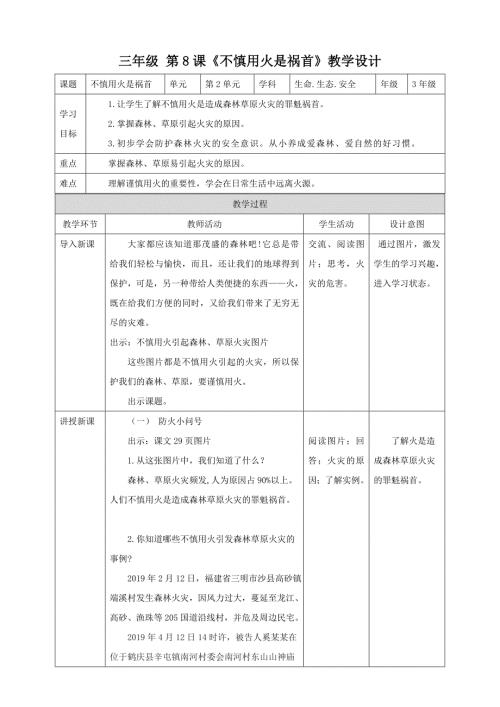
第8课《不慎用火是祸首》教学设计
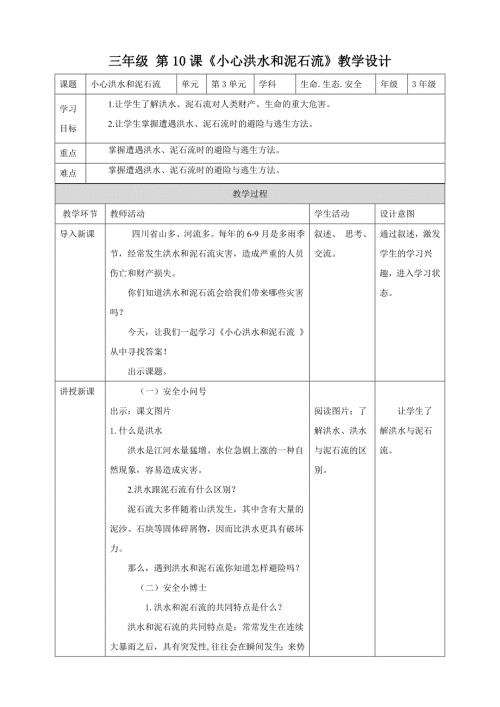
第10课《小心洪水和泥石流》教学设计
第11课《及时治小伤》教学设计
第1课《身体里的“乐队”》教案
第6课《校园避震有办法》教学设计
第18课《有你有我真温暖》教学设计
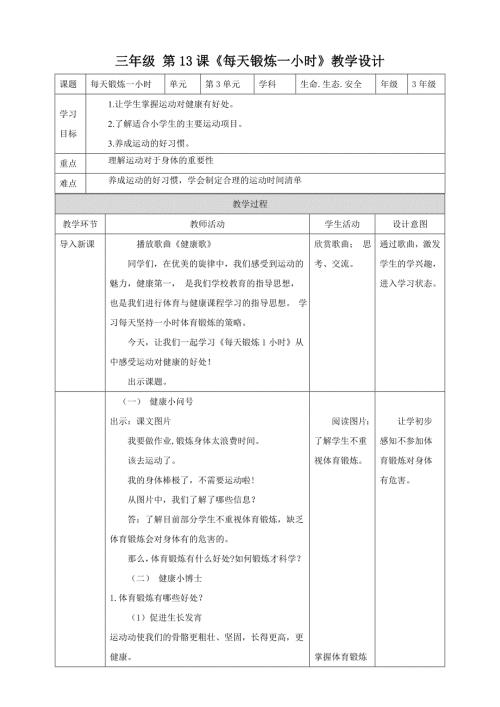
第13课《每天锻炼一小时》教学设计
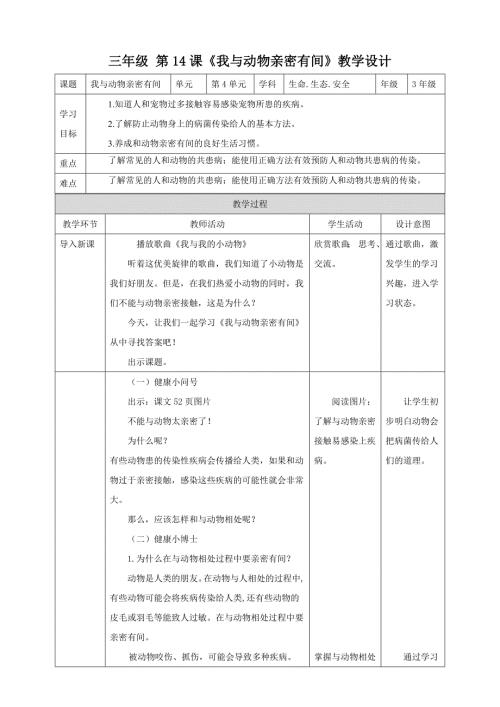
第14课《我与动物亲密有间》教学设计
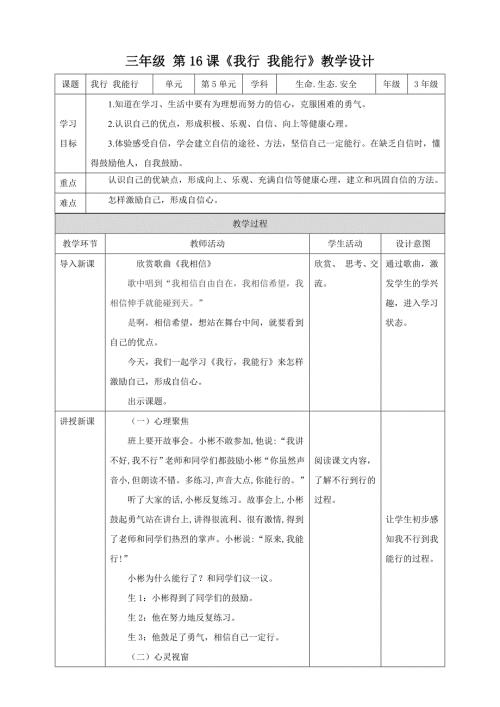
第16课《我行我能行》教学设计
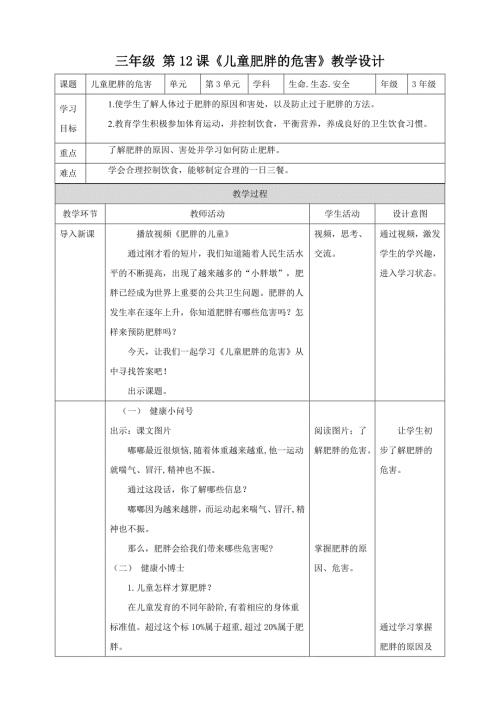
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计
 【+高中语文】《声声慢(寻寻觅觅)》课件+统编版高中语文必修上册
【+高中语文】《声声慢(寻寻觅觅)》课件+统编版高中语文必修上册
2024-04-26 31页
 【+高中语文】《秦腔》课件+统编版高中语文选择性必修下册
【+高中语文】《秦腔》课件+统编版高中语文选择性必修下册
2024-04-26 38页
 【高中语文】《孔雀东南飞+并序》课件++统编版+高中语文选择性必修下册
【高中语文】《孔雀东南飞+并序》课件++统编版+高中语文选择性必修下册
2024-04-26 47页
 【高中语文】《氓》课件+高二语文+同步课件(统编版选择性必修下册)
【高中语文】《氓》课件+高二语文+同步课件(统编版选择性必修下册)
2024-04-26 16页
 【高中语文】《红烛+》课件+统编版高中语文必修上册
【高中语文】《红烛+》课件+统编版高中语文必修上册
2024-04-26 47页
 【高中语文】《窦娥冤》+高一语文同步优质教学课件(统编版必修下册)
【高中语文】《窦娥冤》+高一语文同步优质教学课件(统编版必修下册)
2024-04-26 48页
 【高中语文】《登高》课件+语文必修上册
【高中语文】《登高》课件+语文必修上册
2024-04-26 28页
 【课件】和爸爸骑马遇野兔读后续写讲评课课件
【课件】和爸爸骑马遇野兔读后续写讲评课课件
2024-04-26 32页
 【课件】师德师风第一标准 躬耕教坛 强国有我 课件-2023-2024学年高中师德师风培训学习
【课件】师德师风第一标准 躬耕教坛 强国有我 课件-2023-2024学年高中师德师风培训学习
2024-04-26 13页
 【课件】对班主任工作的一点思考(课件)--2023-2024学年班主任工作经验分享
【课件】对班主任工作的一点思考(课件)--2023-2024学年班主任工作经验分享
2024-04-26 32页

