
核外电子排布规律总结
6页1、原子核外电子排布规律 能量最低原理:电子层划分为KLMOPQ,对应电子层能量增大;原子核外电子排布按照能 量较低者低优先排布原则. 每个电子层最多只能容纳2n2个电子。 最外层最多只能容纳8个电子(K层为最外层时不能超过2个) 次外层最多只能容纳18个电子(K层为次外层时不能超过2个 倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。简单例子的结构特点:(1) 离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布一样,如钠离子、镁离 子、铝离子和氖的核外电子排布是一样的。阴离子更同一周期稀有气体的电子排布一样:负氧离子,氟离子和氖的核外电子排布是一 样的。(2) 等电子粒子(注意主要元素在周期表中的相对位置) 10 电子粒子:CH、N3-、NH-、NH、NH +、O2一、OH-、H 0、H O +、F-、HF、Ne、Na +、Mg2+、423423Al 3+ 等。 18 电子粒子:SiH、P3-、PH、S2-、HS-、H S、Cl-、HC1、Ar、K +、Ca2+、PH + 等。4324特殊情况:F、H O、C H、CH OH222263 核外电子总数与质子总数均一样
2、的阳离子有:Na +、NH +、H O +等;阴离子有:F-、OH-、43NH- ;HS-、Cl -等。2前18号元素原子结构的特殊性:(1) 原子核中无中子的原子: 1H1(2) 最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He(3) 最外层电子总数等于次外层电子数的元素:Be、Ar(4) 最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是 次外层电子数4倍的元素: Ne(5) 最外层电子数是层电子数一半的元素:Li、P(6) 电子层数与最外层电子数相等的元素:H、Be、Al(7) 电子总数为最外层电子数2倍的元素: Be(8) 次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1) 最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2 的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2) 在元素周期表中,同周期的IIA.mA族元素的原子序数差别有:第2、3周期(短周期)元素原子序数都相差1;第4、5周期相差11;第6、7周期相差25(3)同主族、邻
3、周期元素的原子序数差 位于过渡元素左侧的主族元素,即I A、IIA族,同主族、邻周期元素原子序数之差为下一 周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32 位于过渡元素左侧的主族元素,即皿AWA族,同主族、邻周期元素原子序数之差为下一 周期元素所在周期所含元素种数。例如,氯和溴的原子序数之差为35-17=18(溴所在第四周 期所含元素的种数)。相差的数分别为8,18,18,32,32. 同主族非县令的原子序数差为上述连续数的加和,如H和Cs的原子序数为2+8+8+18+18=54(4)元素周期表中除训族元素之外,原子序数为奇数(偶数)的元素,所属所在族的序数与 主要化合价也为奇数(偶数)。如:氯元素的原子序数为17,而其化合价有-1、+1、+3、 +5、 +7,最外层有7个电子,氯元素位于WA族;硫元素的原子序数为16,而其化合价有-2、+4、 +6价,最外层有6个电子,硫元素位于WA族。(5)元素周期表中金属盒非金属元素之间有一分界线,分界线右上方的元素为非金属元素, 分界线左下方的元素为非金属元素(H除外),分界线两边的元素一般既有金属性也有非金属 性。每
4、周期的最右边金属的族序数与周期序数相等,如:Al为第三周期皿A族。元素周期律:(1)原子半径的变化规律:同周期主族元素自左向右,原子半径逐渐增大;同主族元素自上 而下,原子半径逐渐增大。(2)元素化合价的变化规律:同周期自左向右,最高正价:+1+7,最高正价二主族序数(0、 F除外),负价由-4-1,非金属负价=- (8-族序数)(3)元素的金属性:同周期自左向右逐渐减弱;同主族自上而下逐渐增强。(4)元素的非金属性:同周期制作仙游逐渐增强;同主族自上而下逐渐减弱。(5)最高价化合物对应水化物的酸、碱性:同周期自左向右酸性逐渐增强,碱性逐渐减弱; 同主族自上而下酸性逐渐减弱,碱性逐渐增强。(6)非金属气态氢化物的形成难以、稳定性:同周期自左向右形成由难到易,稳定性逐渐增 强;同主族自上而下形成由易到难,稳定性逐渐减弱。原子核外电子按照轨道式排布时遵守下列次序: 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p规律总结:s有1个轨道,最多容纳2个电子p有3个轨道,最多容纳6个电子d有5个轨道,最多容纳10个电子f有7个轨道,最多容纳14个电子每一个轨道可以容纳
《核外电子排布规律总结》由会员hs****ma分享,可在线阅读,更多相关《核外电子排布规律总结》请在金锄头文库上搜索。

2023年精选公司委托书模板锦集九篇

我班趣味故事多

沥青混凝土单位出纳工作总结

融合学科特性以激发学生学习英语兴趣孙万书

关于我校生活污水二次利用可行性的调查研究

七年级数学上册第2章有理数2.6有理数的加法2.6.1有理数的加法法则练习新版华东师大版

金属硅冶炼企业火灾爆炸事故专项应急预案

龙镇百乐小学毕业班工作总结材料

购车请示报告范本

煤矿生产安全事故应急预案管理办法范文(4篇)

各类肉类各部位英语

数列中蕴涵的数学思想

单位交通安全管理制度

美术教研组工作计划

追悼会家属答谢词汇总十篇

初中化学教师实验技能比赛试题及评分标准

传播合同范本
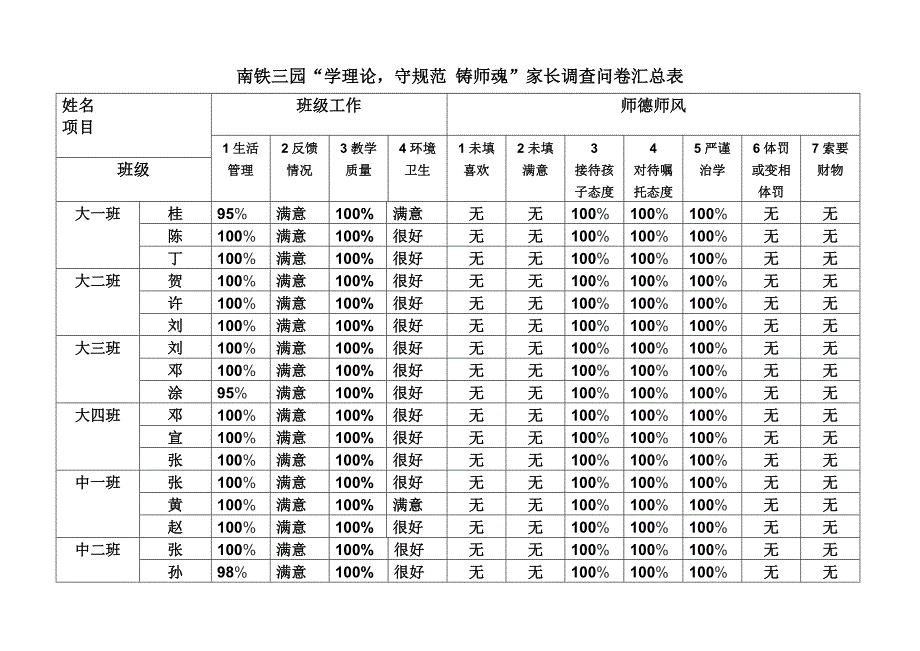
南铁三园“学理论守规范铸师魂”家长调查问卷汇总表

第九章细胞质遗传

移动支付接入服务协议
 QCDMS现场管理大目标修订版
QCDMS现场管理大目标修订版
2023-04-15 3页
 河北省2016年下半年房地产估价师相关知识辐射污染考试试卷
河北省2016年下半年房地产估价师相关知识辐射污染考试试卷
2023-05-29 8页
 预制混凝土方桩
预制混凝土方桩
2023-06-02 41页
 现金流量表的复核审查
现金流量表的复核审查
2023-01-22 3页
 数列中蕴涵的数学思想
数列中蕴涵的数学思想
2023-04-03 6页
 路灯杆生产工艺流程
路灯杆生产工艺流程
2023-08-17 7页
 第九章细胞质遗传
第九章细胞质遗传
2023-09-27 13页
 检验科免疫室工作流程
检验科免疫室工作流程
2022-11-11 1页
 货币金融学课后答案米什金
货币金融学课后答案米什金
2024-01-24 11页
 第六讲 掌握议论文常见的6种论证方法
第六讲 掌握议论文常见的6种论证方法
2023-04-29 12页

