
【初中化学】 常见的酸和碱(第四课时)
15页1、 课题1 常见的酸和碱(第四课时) 碱碱的的化化学学性性质质1 1、与酸碱指示剂反应、与酸碱指示剂反应碱碱能能使使紫色石蕊溶液变石蕊溶液变蓝色 ,碱碱能能使无色酚酞溶液使无色酚酞溶液红色 。2 2、碱碱 + +非金属氧化物非金属氧化物盐盐 + + 水水 NaOH+ 硼酸硼酸 硼酸钠硼酸钠 + H2O 3、碱碱 +酸酸 盐盐 + 水水2NaOH + CO2 = Na2CO3 +H2OCa(OH)2 + CO2= CaCO3 +H2O知识回顾 课题1 常见的酸和碱(第四课时) 1、认识酸、碱溶液导电性的原因;2、掌握酸、碱具有化学通性的原因。自主探究 阅读教材阅读教材p57p57内容及有关插图内容及有关插图, ,完成完成基训基训p p124124“课前预习课前预习”内容并回答有关问题。内容并回答有关问题。学习目标 课题1 常见的酸和碱(第四课时) 2.2.酸酸溶溶液液具具有有相相似似的的化化学学性性质质是是因因为为酸酸在在水水溶溶液液中中能能解解离离出出_和和_,即即在在不不同同的的酸酸溶溶液液中中都都含含有有相相同同的的_; 3.3.碱碱溶溶液液具具有有相相似似的的化化学学性性质质是是因
2、因为为碱碱在在水水溶溶液液中中能能解解离离出出_和和_,即即在在不不同同的的碱碱溶溶液液中中都都含含有有相相同同的的_。 氢离子酸根离子氢离子金属离子氢氧根离子氢氧根离子 能导电的溶液有能导电的溶液有 ( (灯亮灯亮) )不能导电的溶液有不能导电的溶液有 ( (灯不亮灯不亮) )盐酸盐酸硫酸硫酸氢氧化钠溶液氢氧化钠溶液氢氧化钙溶液氢氧化钙溶液蒸馏水蒸馏水乙醇乙醇1.1.自学检测自学检测4 4 2分钟分钟盐酸盐酸 硫酸硫酸氢氧化钠溶液氢氧化钠溶液氢氧化钙溶液氢氧化钙溶液蒸馏水蒸馏水乙醇乙醇基训基训p124p1242 2T T 课题1 常见的酸和碱(第四课时) 课题1 常见的酸和碱(第四课时) 物质盐酸硫酸 NaOH溶液 Ca(OH)2溶液蒸馏水乙醇导电性HCl溶液溶液 H2SO4溶液溶液 NaOH溶液溶液 Ca(OH)2溶液溶液物质导电原因物质导电原因 酸酸酸酸溶液、碱溶液为什么能导电?溶液、碱溶液为什么能导电?溶液、碱溶液为什么能导电?溶液、碱溶液为什么能导电?而蒸馏水、乙醇为什而蒸馏水、乙醇为什而蒸馏水、乙醇为什而蒸馏水、乙醇为什么不导电?么不导电?么不导电?么不导电?溶液:溶液:溶
3、质:溶质:溶解于水时溶解于水时“解离解离”出带电的离子出带电的离子HCl H2SO4 NaOH Ca(OH)2酸碱溶酸碱溶液中的液中的粒子粒子分子分子无法自由无法自由移动的离子移动的离子能够自由移动的离子能够自由移动的离子酸酸 H H+ + + + 酸根离子酸根离子 在水溶液中在水溶液中电电 离离碱碱 金属离子金属离子 + OH+ OH在水溶液中在水溶液中电电 离离 在不同的酸溶液中都含有相同的在不同的酸溶液中都含有相同的在不同的酸溶液中都含有相同的在不同的酸溶液中都含有相同的H H+ +,所以,酸有一些相似的性质。,所以,酸有一些相似的性质。,所以,酸有一些相似的性质。,所以,酸有一些相似的性质。 在不同的碱溶液中都含有相同的在不同的碱溶液中都含有相同的OHOH,所以碱也有一些相似的性质。,所以碱也有一些相似的性质。H H2 2SOSO4 4 2 H2 H+ + + SO+ SO4 42 2- HCl H+ + Cl-NaOH NaOH = = NaNa+ + + OH+ OH-Ca(OH)Ca(OH)2 2= Ca= Ca2+ 2+ + 2 OH+ 2 OH- 课题1 常见的酸和碱
4、(第四课时) NaCl =Na+ + Cl-K2CO3=2K+CO32-CaCl2 = Ca2+2Cl-Na2CO3=2Na+CO32-盐的概念:盐:由金属离子和酸根盐:由金属离子和酸根离子构成的。离子构成的。盐在水溶液中能电离出盐在水溶液中能电离出金属离子金属离子和和酸根离子酸根离子。 课题1 常见的酸和碱(第四课时) 酸的化学性质酸的化学性质酸H+酸酸根根离离子子与酸碱指示剂反应与酸碱指示剂反应酸酸能能使紫色石蕊溶液变使紫色石蕊溶液变红色红色 ,酸酸不能不能使无色酚酞溶液使无色酚酞溶液变色变色 。活泼金属活泼金属 + +酸酸 = = 盐盐+ +氢气氢气Fe +2 HCl = FeCl2 + H2Zn + H2SO4 = Zn SO4 + H2Fe2O3 + 6HCl = 2FeCl3+ 3H2OFe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 酸酸+金属氧化物金属氧化物 盐盐 + 水水CuO + H2SO4 = CuSO4+ H2O酸基训基训p124p1243 3T T 课题1 常见的酸和碱(第四课时) 碱的化学性质碱的化学性质OH-+金金属属离离子子与酸碱指示剂
5、与酸碱指示剂反应反应碱碱能能使紫色石蕊溶液变使紫色石蕊溶液变蓝色蓝色 ,碱碱不能不能使无色酚酞溶液使无色酚酞溶液红色红色 。非金属氧化物非金属氧化物 +碱碱盐盐 + 水水碱CO2+Ca(OH)2=CaCO3+H2OCO2 +2NaOH = Na2CO3 + H2OSO2+2NaOH=Na2SO3+H2O SiO2+2NaOH=Na2SiO3+H2O 基训基训p124p1243 3、5 5、6 6、7 7、8 8、1010、11T11T 课题1 常见的酸和碱(第四课时) 实验室中有一瓶长时间敞口放置的氢氧化钠固体,现称取10克样品(假设样品中只含有碳酸钠一种杂质)向其中加入50克一定溶质质量分数的足够的稀盐酸,充分反应后,称得剩余溶液的质量为58.9克.求样品中氢氧化钠的质量分数是多少?( Na2CO3+2HCl=2NaCl+H2O+CO2解:设样品中含碳酸钠的质量为解:设样品中含碳酸钠的质量为X X生成二氧化碳的质量生成二氧化碳的质量= =( (10g+50g10g+50g) )-58.9g=1.1g-58.9g=1.1g Na Na2 2COCO3 3 +2HCl = 2NaCl +
《【初中化学】 常见的酸和碱(第四课时)》由会员琦琪分享,可在线阅读,更多相关《【初中化学】 常见的酸和碱(第四课时)》请在金锄头文库上搜索。

【初中化学】 化学是一门以实验为基础的科学 (第一课时)

【初中化学】化学使世界变得更加绚丽多彩

【初中化学】 水的净化

【初中化学】 《有机合成材料》

【初中化学】 酸 和 碱复习
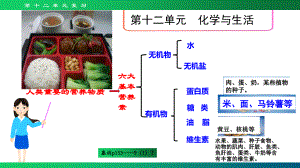
【初中化学】第十二单元《化学与生活》复习

【公务员考试】【2022年及历年】最新《申论》真题及答案解析汇总(38套)-精

【初中化学】溶液的形成

【初中化学】 化学肥料

【初中化学】生活中常见的盐(第三课时)

【初中化学】 常见的酸和碱(第一课时)

【初中化学】生活中常见的盐(第二课时)
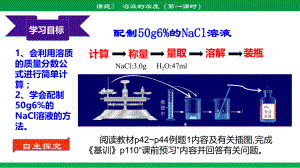
【初中化学】 溶液的浓度(第一课时)

【初中化学】 常见的酸和碱(第四课时)

【初中化学】化学是一门以实验为基础的科学 (第二课时)
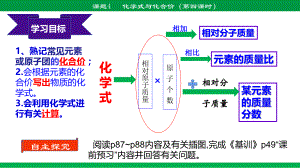
【初中化学】 化学式与化合价(第四课时)

【初中化学】物质的变化和性质(第一课时)

【初中化学】化学式与化合价(第二课时)

【初中化学】溶解度(第一课时)

【初中化学】《金属和金属材料》复习
 陕西2023年中考地理试题(含答案)
陕西2023年中考地理试题(含答案)
2024-05-07 19页
 重庆市2023年中考地理试题(含答案)
重庆市2023年中考地理试题(含答案)
2024-05-07 13页
 四川省宜宾市2023年中考地理试题(含答案)
四川省宜宾市2023年中考地理试题(含答案)
2024-05-07 12页
 四川省南充市2023年中考地理试题(含答案)
四川省南充市2023年中考地理试题(含答案)
2024-05-07 12页
 四川省泸州市2023年中考地理试题(含答案)
四川省泸州市2023年中考地理试题(含答案)
2024-05-07 7页
 四川省眉山市2023年中考地理试题(含答案)
四川省眉山市2023年中考地理试题(含答案)
2024-05-07 9页
 2023年山西省晋中市中考地理试题(含答案)
2023年山西省晋中市中考地理试题(含答案)
2024-05-07 12页
 2023年四川省达州市中考地理试题(含答案)
2023年四川省达州市中考地理试题(含答案)
2024-05-07 8页
 四川省内江市2023年中考地理试题(含答案)
四川省内江市2023年中考地理试题(含答案)
2024-05-07 10页
 2023年安徽省中考地理试题试题(含答案)
2023年安徽省中考地理试题试题(含答案)
2024-05-07 7页

