
ICH 生物技术药物的临床前安全性评价 S6 R1.pdf
22页1、人用药品注册技术要求国际协调会 ICH 三方协调指导原则三方协调指导原则 生物技术药物的临床前安全性评价生物技术药物的临床前安全性评价 S6 R1 1997年7月16日总指导原则 现行第四阶段版本 2011年6月底整合2011年6月12日的附录 本指导原则由相应的ICH专家小组制定 按照ICH进程 已递交管理部门讨论 在ICH进程第四 阶段 最终草案被推荐给欧盟 日本和美国的管理机构采纳 S6 R1 文件历史 文件历史 最初版本 历史 日期 新版本 2005年年11月月 总指导原则 生物技术药物的临床前安全性评价总指导原则 生物技术药物的临床前安全性评价 S6 指导委员会批准进入第二阶段 并发布以公开征询意见 1996年11月6 日 S6 S6 指导委员会批准进入第四阶段 并推荐给三方ICH管理机构 采纳 1997年7月16 日 S6 总指导原则附录总指导原则附录 S6 R1 指导委员会批准此附录进入第二阶段 并发布以公开征询 意见 2009年10月 29日 S6 R1 现行现行第四阶段第四阶段版本版本 S6 R1 指导委员会批准此附录进入第四阶段 并推荐给三方ICH 管理机构采纳 总
2、指导原则整合附录后重新命名为S6 R1 2011年6月12 日 S6 R1 i 生物技术药物的临床前安全性评价生物技术药物的临床前安全性评价 ICH三方协调指导原则三方协调指导原则 目录目录 第第I部分 部分 1 1 前言前言 1 1 1 背景背景 1 1 2 目的目的 1 1 3 范围范围 1 2 受试物受试物的质量标准的质量标准 2 3 临床前安全性试验临床前安全性试验 2 3 1 一般原则一般原则 2 3 2 生物活性生物活性 药效学药效学 3 3 3 动物种属动物种属 模型选择模型选择 3 3 4 动物的数量动物的数量 性别性别 4 3 5 给药途径给药途径 剂量选择剂量选择 4 3 6 免疫原性免疫原性 4 4 特殊考虑特殊考虑 5 4 1 安全药理学安全药理学 5 4 2 暴露评价暴露评价 5 4 2 1 药代动力学和毒代动力学药代动力学和毒代动力学 5 4 2 2 测定测定 6 4 2 3 代谢代谢 6 4 3 单次给药毒性研究单次给药毒性研究 6 4 4 重复给药毒性研究重复给药毒性研究 6 4 5 免疫毒性研究免疫毒性研究 7 4 6 生殖能力和发育毒性研究生殖能力和
3、发育毒性研究 7 4 7 遗传毒性研究遗传毒性研究 7 4 8 致癌性研究致癌性研究 7 4 9 局部耐受性研究局部耐受性研究 8 注释注释 8 第第II部分 部分 9 1 前言前言 9 ii 1 1 附录目的附录目的 9 1 2 背景背景 9 1 3 指导原则的范围指导原则的范围 9 2 种属的选择种属的选择 10 2 1 一般原则一般原则 10 2 2 一或两个种属一或两个种属 10 2 3 同源蛋白的使用同源蛋白的使用 11 3 研究设计研究设计 11 3 1 剂量选择和剂量选择和PK PD原则的应用原则的应用 11 3 2 研究期限研究期限 11 3 3 恢复恢复 11 3 4 探索性临床研究探索性临床研究 12 4 免疫原性免疫原性 12 5 生殖和发育毒性生殖和发育毒性 12 5 1 一般评论一般评论 12 5 2 生育能力生育能力 13 5 3 胚胎胚胎 胎儿发育 胎儿发育 EFD 和出生前 和出生前 后的发育 后的发育 PPND 13 5 4 研究的时间安排研究的时间安排 14 6 致癌性致癌性 14 注释注释 15 参考文献参考文献 18 1 第第I部分 部分 生物技
4、术药物的临床前安全性评价生物技术药物的临床前安全性评价 ICH三方协调指导原则三方协调指导原则 在1997年7月16日的ICH指导委员会会议上进入ICH进程第四阶段 本指导原则被推荐给三方 ICH管理机构采纳 1 前言前言 1 1 背景背景 生物技术药物 生物药物 的开发始于20世纪80年代初 80年代后期批准了第一个上市许 可 对于生物技术药物的安全性评价 不同的管理机构已发布了一些指导原则和考虑要点文件 管理机构对这些文件的回顾 可能会为开发新生物药物提供有用的背景资料 目前 生物药物的申报已积累了大量的经验 对这些经验的重要回顾 为本指导原则的制 定奠定了基础 本文的目的在于为设计科学合理的临床前安全性评价试验提供总体原则 1 2 目的目的 目前 欧盟 日本和美国对于生物技术药物的监管标准基本一致 三方均采用灵活 个案 处理和基于科学的方法评价临床前安全性 支持临床开发和上市许可 在这一快速发展的科学 领域 需要地区之间达成共识并且保持持续对话 临床前安全性评价的主要目的是 1 确定人体使用的安全起始剂量和随后的剂量递增方案 2 确定潜在毒性靶器官并研究这种毒性是否可逆 以及3
5、确定临床监测的安全性参数 本文 件提供的原则旨在提高支持性临床前安全性数据的质量和一致性 以利于生物药物的开发 1 3 范围范围 本指导原则的主要目的是推荐一种评价生物技术药物临床前安全性的基本模式 适用于采 用多种表达系统的已鉴定细胞 如细菌 真菌 昆虫 植物和哺乳动物细胞 所制备的产品 这些产品可用于体内诊断 治疗或预防 其活性物质包括蛋白质 多肽及其衍生物或由其组成 的产品 它们可能是细胞培养衍生物 或者采用重组DNA技术 包括通过转基因植物和动物生 产的产品 例如 包括但不限于 细胞因子 纤维蛋白溶酶原激活因子 重组血浆因子 生 长因子 融合蛋白 酶 受体 激素和单克隆抗体 本文中的原则可能也适用于重组DNA蛋白疫苗 化学合成多肽 血浆衍生产品 从人组织 提取的内源性蛋白和寡核苷酸药物 本文件适用范围不包括抗生素 变应原提取物 肝素 维生素 血细胞成分 常规的细菌 Preclinical Safety Evaluation of Biotechnology Derived Pharmaceuticals 2 或病毒疫苗 DNA疫苗或者细胞和基因疗法 2 受试物受试物的质量标准的
《ICH 生物技术药物的临床前安全性评价 S6 R1.pdf》由会员飞****9分享,可在线阅读,更多相关《ICH 生物技术药物的临床前安全性评价 S6 R1.pdf》请在金锄头文库上搜索。

第三单元 秦汉时期:统一多民族国家的建立和巩固(单元复习好卷)

七年级历史阶段性学业水平测试

《论语》十二章全面解读

Web前端开发案例教程:12完整项目化妆品网站设计与实现

编程基础与实例教程-PHP

2019年抚顺市第六中学高考生物简单题专项训练(含解析)

2019年教科版八年级物理上册全册学案

2019年宝鸡晨光中学高考生物简单题专项训练(含解析)

2019年象山港书院高考生物简单题专项训练(含解析)

2019年一级建造师工程经济考点总结

2019年小学教育教学工作总结4篇

2019年浙江省金华市中考数学试卷(解析版)
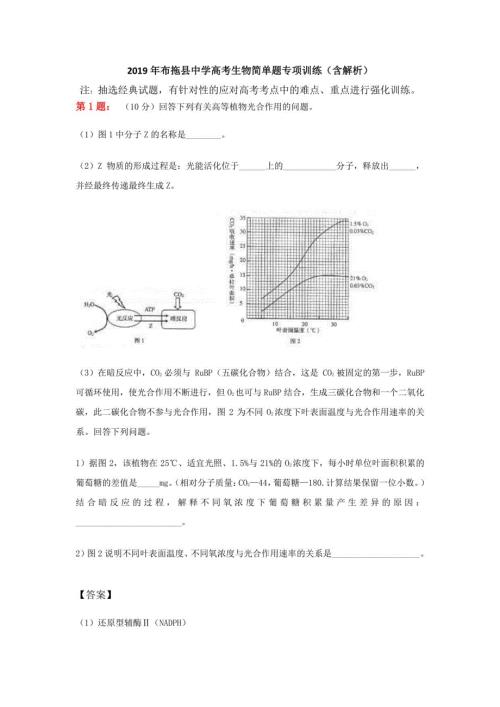
2019年布拖县中学高考生物简单题专项训练(含解析)

2010年卫生系列中级职称内科学风湿及结缔组织病习题及参考答案
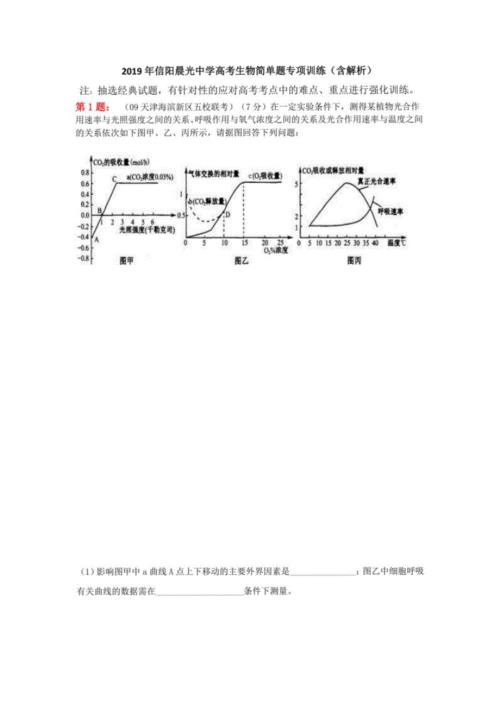
2019年信阳晨光中学高考生物简单题专项训练(含解析)

2018年一级建造师市政实务必考点

2019年和县第三中学高考生物简单题专项训练(含解析)

2018高考化学微题型微考点训练1--20

2019年大理市大理第二中学高考生物简单题专项训练(含解析)
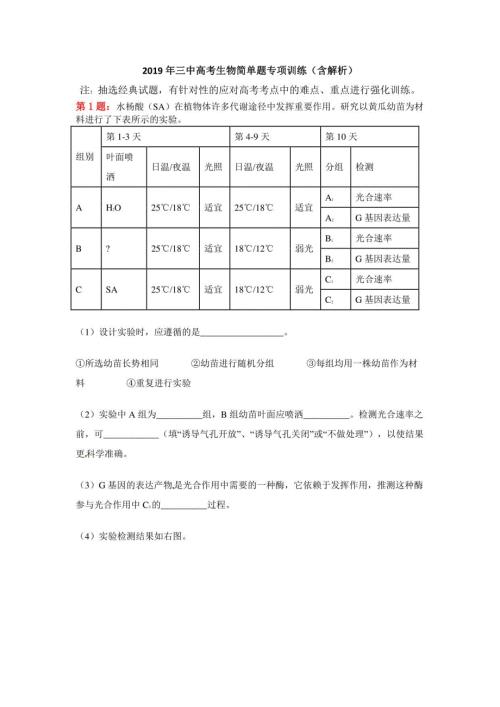
2019年三中高考生物简单题专项训练(含解析)
 某县委书记在软弱涣散(后进)村党组织排查整顿座谈会上的讲话
某县委书记在软弱涣散(后进)村党组织排查整顿座谈会上的讲话
2024-05-16 6页
 热力公司关于深刻把握国有经济和国有企业高质量发展根本遵循研讨发言提纲(范文)
热力公司关于深刻把握国有经济和国有企业高质量发展根本遵循研讨发言提纲(范文)
2024-05-16 8页
 某市税务局党委书记、局长在党委理论学习中心组“党纪学习教育”专题学习会上的讲话
某市税务局党委书记、局长在党委理论学习中心组“党纪学习教育”专题学习会上的讲话
2024-05-16 6页
 某县政法委书记在县级领导干部党纪学习教育专题读书班上的交流发言
某县政法委书记在县级领导干部党纪学习教育专题读书班上的交流发言
2024-05-16 6页
 某市税务局党委书记、局长在党委理论学习中心组党纪学习教育专题学习会上的讲话
某市税务局党委书记、局长在党委理论学习中心组党纪学习教育专题学习会上的讲话
2024-05-16 6页
 央企金融行业关于深刻把握国有经济和国有企业高质量发展根本遵循研讨发言提纲(范文)
央企金融行业关于深刻把握国有经济和国有企业高质量发展根本遵循研讨发言提纲(范文)
2024-05-16 8页
 某县委书记在县委理论学习中心组新质生产力学习交流会.上的研讨发言材料
某县委书记在县委理论学习中心组新质生产力学习交流会.上的研讨发言材料
2024-05-16 6页
 数据要素央企关于深刻把握国有经济和国有企业高质量发展根本遵循研讨发言提纲(范文)
数据要素央企关于深刻把握国有经济和国有企业高质量发展根本遵循研讨发言提纲(范文)
2024-05-16 7页
 某县直机关党员干部党纪学习教育心得交流发言
某县直机关党员干部党纪学习教育心得交流发言
2024-05-16 6页
 某县长党纪学习教育读书班交流研讨材料
某县长党纪学习教育读书班交流研讨材料
2024-05-16 9页

