
ICH 生物技术生物制品在生产工艺变更前后的可比性 Q5E.pdf
15页1、人用药品注册技术要求国际协调会人用药品注册技术要求国际协调会 ICH 三方协调指导原则三方协调指导原则 生物技术生物技术 生物制品在生产工艺变更前后的可比性生物制品在生产工艺变更前后的可比性 Q5E 2004 年年 11 月月 18 日日 现行第四阶段版本现行第四阶段版本 按照 ICH 进程 本指导原则由相应的 ICH 专家组制定 已递交管理部门磋商 在 ICH 第四 阶段 最终草案推荐给欧盟 日本和美国的药品管理机构 Q5E 文件形成历史 首次编辑 经历 时间 2005 年 11 月最新编 辑 Q5E 在第二阶段通过筹划 指导委员会同意 后 经公开讨论 2003 年 11 月 13 日 Q5E 现行的第四阶段版本 Q5E 在第四阶段通过筹划 指导委员会同意 并 推荐给ICH三方协调 部门采纳 2004 年 11 月 18 日 Q5E 生物技术生物技术 生物制品在生产工艺变更前后的可比性生物制品在生产工艺变更前后的可比性 ICH 三方协调指导原则 2004 年 11 月 18 日举行的 ICH 筹划指导委员会会议上 ICH 进程已经到达第四阶段 本指 导原则被推荐给 ICH 三方协调部
2、门采纳 目 录 1 前言 1 1 指导原则的目的 1 1 2 背景 1 1 3 范围 1 1 4 基本原则 2 2 指导原则 2 2 1 可比性试验应考虑的问题 3 2 2 质量的考虑 3 2 2 1 分析技术 4 2 2 2 鉴定 4 2 2 3 检定规程 5 2 2 4 稳定性 7 2 3 生产工艺的考虑 7 2 4 开发过程中可比性的验证 8 2 5 非临床和临床的考虑 10 2 5 1 在设计非临床和临床研究中应考虑的因素 10 2 5 2 研究类型 11 3 术语 11 4 参考文献 12 生物技术生物技术 生物制品在生产工艺改变前后的可比性生物制品在生产工艺改变前后的可比性 1 前言前言 1 1 指导原则的目的指导原则的目的 本文件的目的是提供一个指导原则 用于评估原液或药物制剂的生物技术 生物制品生 产工艺变更前后的可比性 因此 本指导原则的目的在于帮助收集相关技术信息 以便证明 生产工艺的变更并没有对药物制剂的质量 安全性和有效性产生不利影响 本文件并没有提 供任何特殊的检测分析 非临床或临床策略 主要强调的是质量方面的要求 1 2 背景背景 生物技术 生物制品在开发和
3、获得批准后 其生产商 1经常会变更产品3的生产工艺2 变更的原因包括改进生产工艺 增加规模 提高产品稳定性 以及根据法规要求进行变更 变更生产工艺时 生产商应总体评估产品的有关质量特性 从而证明该改变没有对制剂的安 全性和有效性产生不利影响 4 这样一份评估应该说明 是否还需要进行非临床和临床研究 但 ICH 文件并没有特别强调产品变更前后的可比性研究中的考虑要点 一些 ICH 文件 为提出上市申请的产品提供了关于技术信息和数据的指导原则 这些指导原则对评估生产工 艺的变更 见 4 0 部分参考文献 也是有帮助的 本文件以之前发布的 ICH 指导原则为基础 增加了以下的指导内容 比较生产工艺变更前后的产品 评估由于生产工艺变更对特定的产品质量带来的可检测到的差异 这些差异与产品的安 全性和有效性相关 1 为了方便 生产商 一词包括任何拥有生产中间体 原液和制剂合同的第三方 并代 表市场授权者 或开发商 如果先于市场授权 2 为了方便 生产工艺 一词也包括那些因为可能影响关键工艺参数 从而影响产品质 量的厂房和设备 3 为了方便 没有定语的 产品 一词 指中间体 原液和药物制剂 4 提高
4、产品质量一直是期待和鼓励的 如果可比性实验结果表明 改进的产品质量能够显 著提高有效性和 或安全性 生产工艺变更前后的产品可以是不可比的 然而 这项结果 是否被接受 建议生产商到咨询适宜的地区药管当局 1 3 范围范围 本文件所接受和解释的原则适用于 5 蛋白质和多肽及其衍生物 及以其为成分的产品 例如偶联物 这些蛋白质和多肽采用 重组或非重组细胞培养表达体系生产 能被高度纯化并可被一套合适的分析方法进行结 构表征 生产工艺的变更由独立的生产商进行 包括合同生产商 他们能直接对生产工艺变更前 后的产品检测结果进行比较 生产工艺的变更是指开发过程中或上市后产品的变更 本文件中所概括的原则也同样适用于其他类型的产品 如组织和体液中提取的蛋白质和 多肽 建议生产商向适宜的地区药管当局咨询 以便确定其适用性 1 4 基本原基本原则则 可比性试验的目的在于 确保生产工艺变更后药物制剂的质量 安全性和有效性 通过 收集和评估相关数据 确定生产工艺的变更是否对药物制剂产生任何不良影响 可比性研究并不意味着变更前后的产品在质量特性上是一致的 但它们应高度相似并且 现有知识应能充分预测 以确保质量特性上
5、的任何差别对药物制剂的安全性或有效性不会产 生不利影响 可比性结论应以分析检测 生物学测定以及某些情况下的非临床和临床数据为基础 如 果生产商仅通过单独的分析研究就可以保证比较试验的可靠性 那么变更后产品的非临床或 临床研究就不必进行了 但是 如果还没有建立特异的质量特性和安全性及有效性之间的关 系 并且 观察到变更前后产品在质量特性上有差别时 可比性试验中就应包括质量 非临 床和 或临床的对比研究 为了确认生产工艺变更的影响 应对产品所有可预期后果进行仔细评估 并且应建立适 宜的标准以定义变更后产品的高度相似性 5 这份文件适用于所列举的三种情况 一般情况下 应该有变更前后产品的质量研究数据 并整合和评估所有收集到的数据进 行比较 如常规批次检验 生产过程控制 工艺验证 数据评估 如果适用 还应有结构确 证和稳定性数据 针对先前所确定的标准 应对比较结果进行客观评估 以确定变更前后产 品是否具有可比性 在质量特性评估过程中 生产商可能会得到如下的结果 包括 基于有关质量特性的适宜比较 变更前后的产品高度相似性 被认为具有可比性 也就 是可以预期对产品安全性或有效性没有产生不利影响 虽
《ICH 生物技术生物制品在生产工艺变更前后的可比性 Q5E.pdf》由会员飞****9分享,可在线阅读,更多相关《ICH 生物技术生物制品在生产工艺变更前后的可比性 Q5E.pdf》请在金锄头文库上搜索。

第三单元 秦汉时期:统一多民族国家的建立和巩固(单元复习好卷)

七年级历史阶段性学业水平测试

《论语》十二章全面解读

Web前端开发案例教程:12完整项目化妆品网站设计与实现

编程基础与实例教程-PHP

2019年抚顺市第六中学高考生物简单题专项训练(含解析)

2019年教科版八年级物理上册全册学案

2019年宝鸡晨光中学高考生物简单题专项训练(含解析)

2019年象山港书院高考生物简单题专项训练(含解析)

2019年一级建造师工程经济考点总结

2019年小学教育教学工作总结4篇

2019年浙江省金华市中考数学试卷(解析版)
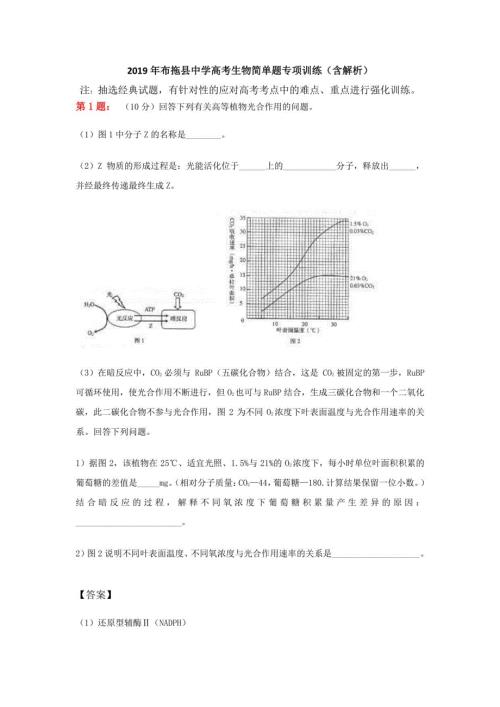
2019年布拖县中学高考生物简单题专项训练(含解析)

2010年卫生系列中级职称内科学风湿及结缔组织病习题及参考答案
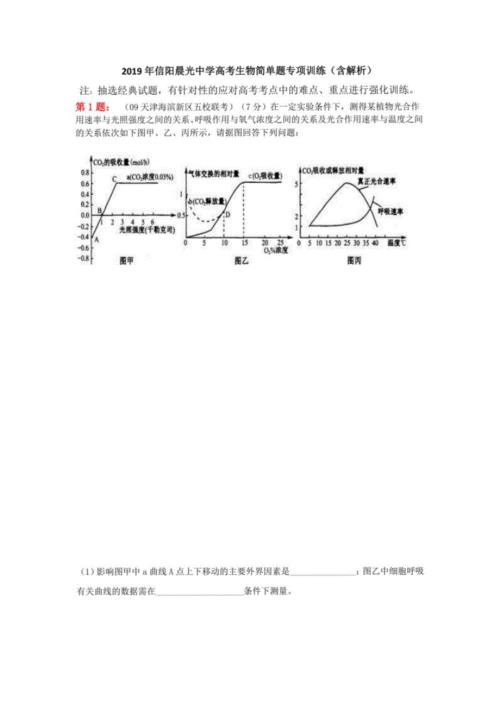
2019年信阳晨光中学高考生物简单题专项训练(含解析)

2018年一级建造师市政实务必考点

2019年和县第三中学高考生物简单题专项训练(含解析)

2018高考化学微题型微考点训练1--20

2019年大理市大理第二中学高考生物简单题专项训练(含解析)
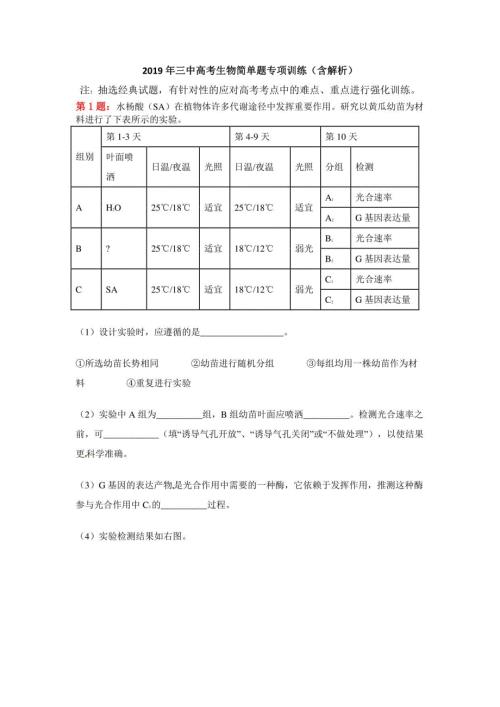
2019年三中高考生物简单题专项训练(含解析)
 耳鼻喉 试卷A.doc
耳鼻喉 试卷A.doc
2023-11-07 16页
 病理重点老师.doc
病理重点老师.doc
2023-03-28 5页
 水和钠的代谢紊乱.doc
水和钠的代谢紊乱.doc
2022-12-28 4页
 内科学-胃肠病学3.doc
内科学-胃肠病学3.doc
2024-03-12 107页
 浅议低氮燃烧技术.doc
浅议低氮燃烧技术.doc
2023-06-22 10页
 临床检验习题.doc
临床检验习题.doc
2023-06-29 4页
 用英语说医疗专业词汇.doc
用英语说医疗专业词汇.doc
2023-03-12 5页
 告诉你一个真实的绩效考核(各种观点).doc
告诉你一个真实的绩效考核(各种观点).doc
2023-10-28 31页
 三年级下语文第六课.doc
三年级下语文第六课.doc
2023-05-12 8页
 新四级英语听力的解题技巧.doc
新四级英语听力的解题技巧.doc
2023-02-02 4页

