
【2017年整理】第三章 水溶液中的离子平衡
17页1、汾阳中学高二化学选修 4 学案1第三章 水溶液中的离子平衡第一节 弱电解质的电离 学案学习目标:1、 能说出电解质、强电解质和弱电解质的概念。2、熟悉强、弱电解质与结构的关系,能正确书写常见物质的电离方程式。3、会判断弱电解质的电离平衡状态以及温度、浓度等条件对电离平衡的影响。学习重点:电离平衡的建立以及电离平衡的移动。学习难点:电离平衡的建立以及电离平衡的移动【课前自主学习】一、请回顾下列知识: 电解质:_ _ _非电解质:_ _ 练习:讨论下列物质中 Cu、NaCl 固体、NaOH 固体、K 2SO4 溶液、CO 2、蔗糖、NaCl溶液、H 2O、酒精。_ _是电解质,_是非电解质,_既不是电解质,也不是非电解质 写出下列物质的电离方程式:NaCl:_ NaOH :_H2SO4: _ NaHCO3_ NaHSO4:_(溶液) NaHSO4:_(熔融)【注意】:离子型的电解质在水溶液中或熔融状态下都可以导电,而共价型的电解质只有在水溶液中才能导电二、阅读教材 P40-41 ,完成下列内容。电解质有强弱之分(认真阅读试验 3-1:得出强电解质与弱电解质的概念)强电解质 弱电解质概念化合
2、物类型电离程度在溶液中存在形式电离过程【试一试】1、下列电解质中:NaCl、NaOH,NH 3H2O、CH 3COOH,BaSO 4,AgCl,Na 2O,K2O,Na 2O2_ _是强电解质_ _是弱电解质2、 CaCO3、Fe(OH) 3 的溶解度都很小, CaCO3 属于强电解质,而 Fe(OH)3 属于弱电解质;CH3COOH、HCl 的溶解度都很大, HCl 属于强电解质,而 CH3COOH 属于弱电解质。电解质的强弱与其溶解性有何关系?怎样区分强弱电解质?3、BaSO 4、AgCl 是强电解质还是弱电解质,为什么?三、阅读教材 P41-42 ,完成下列内容。汾阳中学高二化学选修 4 学案2 电离平衡概念: 电离平衡的特征: 电离方程式的书写:如 CH3COOH NH3H2O H2O4影响弱电解质电离平衡的因素:【课堂互动探究】一、强电解质与弱电解质的比较强电解质 弱电解质定义化合物类型电离程度电离过程溶液中存在粒子(水分子不计)实例二、弱电解质的电离平衡1、影响弱电解质电离平衡的因素:(1)温度:温度升高,电离平衡向右移动,电离程度增大。温度降低,电离平衡向左移动,电离程度
3、减小。(2)浓度:电解质溶液浓度越大,平衡向右移动,电离程度减小;电解质溶液浓度越小,平衡向左移动,电离程度增大;当外界条件(如浓度、温度等 )发生变化时,电离平衡就会发生移动。弱电解质的电离平衡移动遵循化学平衡移动原理。现以 0.1 molL1 的 CH3COOH 溶液为例,分析影响电离平衡的因素及平衡移动结果。电离方程式为 CH3COOH CH3COO H 。(如下表)A影响因素 平衡移动方向 n(H ) c(H ) c(CH3COO ) Ka pH 导电能力升温(不考虑挥发)加冰醋酸CH3COONa固体通 HCl 气体加入其他物质NaOH加水稀释2、电离平衡常数(结合化学平衡常数体会)例如: COH3 HCO3 )COH(3acK汾阳中学高二化学选修 4 学案3【课堂小结】请把你本节课的收获和困惑写下来与同学或老师交流吧第三章 水溶液中的离子平衡第一节 弱电解质的电离 练习【课后知识反馈】 在甲酸的下列性质中,可以证明它是弱电解质的是( )A1mol/L 的甲酸溶液中 c(H +)约为 1102 mol/L B甲酸能与水以任意比例互溶C1mol/L 的甲酸溶液 10mL 恰好与
《【2017年整理】第三章 水溶液中的离子平衡》由会员姜**分享,可在线阅读,更多相关《【2017年整理】第三章 水溶液中的离子平衡》请在金锄头文库上搜索。

【2017年整理】第三章 提取

【2017年整理】第三章 水溶液中的离子平衡

【2017年整理】第三章 设备平面布置
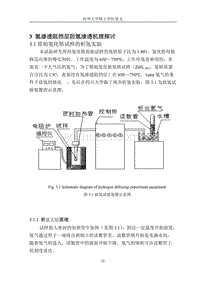
【2017年整理】第三章 氢渗透阻挡层防氢渗透机理探讨

【2017年整理】第三章 桥梁的作用

【2017年整理】第三章 汽轮机在变工况下的工作

【2017年整理】第三章 汽车空调制冷系统的温度控制

【2017年整理】第三章 气相色谱法
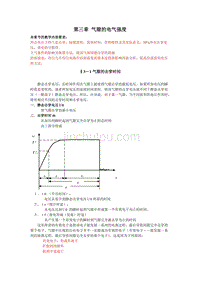
【2017年整理】第三章 气隙的电气强度
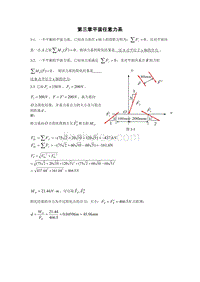
【2017年整理】第三章 平面任意力系

【2017年整理】第三章 木 材

【2017年整理】第三章 母线安装-说明计算规则

【2017年整理】第三章 模具故障排除

【2017年整理】第三章 酶的提取与分离纯化

【2017年整理】第三章 逻辑门电路

【2017年整理】第三章 理想气体的性质与热力过程

【2017年整理】第三章 离散傅立叶变换

【2017年整理】第三章 拉线
![【2017年整理】第三章 矿用自卸汽车机械构造3-8[1]](https://union.01img.goldhoe.com/2017-5/25/441c6217-168a-4dcc-8bfc-10e8da1203e0/pic1.gif)
【2017年整理】第三章 矿用自卸汽车机械构造3-8[1]
【2017年整理】第三章 矿井通风与灾害防治
 220kV母差保护讲课print
220kV母差保护讲课print
2023-06-02 7页
 唐山的地域文化
唐山的地域文化
2022-12-04 8页
 南开大学22春《职场心理麦课》1709、1803、1809、1903、1909、2003、2009综合作业二答案参考17
南开大学22春《职场心理麦课》1709、1803、1809、1903、1909、2003、2009综合作业二答案参考17
2022-11-27 16页
 川农21春《室内装饰材料专科》在线作业二满分答案86
川农21春《室内装饰材料专科》在线作业二满分答案86
2024-02-12 14页
 福建师范大学21春《现代教育技术》离线作业一辅导答案98
福建师范大学21春《现代教育技术》离线作业一辅导答案98
2023-03-04 13页
 地大21春《证券投资学》在线作业二满分答案88
地大21春《证券投资学》在线作业二满分答案88
2024-02-01 14页
 中国医科大学22春《系统解剖学中专起点大专》综合作业二答案参考15
中国医科大学22春《系统解剖学中专起点大专》综合作业二答案参考15
2023-12-30 14页
 电子科技大学22春《JAVA程序设计》综合作业二答案参考40
电子科技大学22春《JAVA程序设计》综合作业二答案参考40
2023-10-29 14页
 南开大学22春《政府公共关系学》综合作业二答案参考29
南开大学22春《政府公共关系学》综合作业二答案参考29
2022-08-28 14页
 曹云金刘云天《黄鹤楼》台词
曹云金刘云天《黄鹤楼》台词
2024-01-18 13页

