
高中化学-苏教版-必修一-专题三-知识点总结教学提纲
10页1、精品文档专题 3从矿物到基础材料第一单元从铝土矿到铝合金铝的制取溶解: Al 2O3+2NaOH = 2NaAlO 2+H 2O过滤:除去杂质酸化: NaAlO 2+CO 2+2H 2O = Al(OH) 3 +NaHCO 3过滤:保留氢氧化铝通电灼烧: 2Al(OH) 3=4Al+3O 2铝合金特点 :1、密度小2、强度高3、塑性好4、制造工艺简单5、成本低6、抗腐蚀力强铝的化学性质(1)与酸的反应 : 2Al + 6HCl = 2AlCl3 + 3H2( 2) 与碱的反应 : 2Al+2NaOH+2H O=2NaAlO +3H 22 2第一步: 2Al+6H2O= 2Al(OH) 3+3H2第二步: Al(OH) +NaOH=NaAlO+2H O322 总方程式: 2Al+2NaOH+6H O=2NaAlO + 4HO+3H 2222( 3) 钝化 :在常温下,铝与浓硝酸、浓硫酸时会在表面生成致密的氧化膜而发生钝化,不与浓硝酸、浓硫酸进一步发生反应。( 4) 铝热反应 :高温2Al + Fe2O3 = 2Fe + Al 2O3铝热剂:铝粉和某些金属氧化物(Fe O 、FeO、 Fe
2、 O 、 V O 、Cr O 、MnO)组成的233425232混合物。氧化铝的化学性质(两性氧化物)氧化铝的用途高硬度、熔点高,常用于制造耐火材料精品文档精品文档氢氧化铝(两性氢氧化物)( 1)与酸的反应: Al(OH) 3 + 3HCl = AlCl3 + 3H2O( 2) 与碱的反应: Al(OH) 3 + NaOH = NaAlO 2 + 2H2O氯化铝的制取:氯化铝与氨水反应AlCl3+3NH3H2O=Al(OH ) 3 +NH4Cl3氯化铝与氢氧化钠溶液反应AlCl3+3NaOH=Al (OH ) 3+3NaCl AlCl3+4NaOH=NaAlO2+2H2O+3NaCl第二单元铁、铜及其化合物的应用常见的铁矿石和铜矿石铁的冶炼方法( 1)制取 CO:C+O 2 = CO 2 ,CO2+C =CO( 2)还原(炼铁原理) : Fe2O 3 + 3CO = 2Fe + 3CO2高温高温( 3) 除 SiO 2: CaCO3=CaO+CO 2, CaO+SiO2=CaSiO 3铜的冶炼方法1.高温冶炼黄铜矿电解精制;2.湿法炼铜: Fe + CuSO4 = FeSO 4 + C
3、u ; 3. 生物炼铜铁、铜的化学性质铁的化学性质:铁是较活泼的金属(或中等活泼金属)表现为还原性。铁铜铁生锈(铁在潮湿空气中被腐蚀生成Fe O)Cu +O = 2CuO2 32( 1)与非金属反 2Fe+3Cl点燃点燃2 = 2FeCl 3Cu + Cl 2= CuCl 2应 2Fe+3Br点燃还原性: Fe2+2 = 2FeBr 3Br2Cu + S = Cu 2S点燃3 4(2 价 Fe 占 1 ,2 价 Fe 占 23)3Fe+2O = Fe O3非强氧性的酸: Fe + 2H+ = Fe 2+ + H 2非强氧性的酸 :不反应强氧性的酸(浓 H SO、 HNO):强氧性的酸(浓H SO、 HNO):在一定243243精品文档精品文档( 2)与酸反应a. 常温下钝化 ( 浓 H2SO4、浓 HNO3用铁制容器盛装 )条件下生成 Cu( )b. 一定条件下反应生成Fe()(1) Fe + Cu2+ = Fe 2+ CuCu + 2Ag +=2Ag + Cu 2+( 3)与盐溶液反(2) Fe + 2Fe3+ = 3Fe2+Cu + 2Fe 3+=2Fe2+ + Cu 2+(实验现
《高中化学-苏教版-必修一-专题三-知识点总结教学提纲》由会员大米分享,可在线阅读,更多相关《高中化学-苏教版-必修一-专题三-知识点总结教学提纲》请在金锄头文库上搜索。

2023年电教工作计划(3篇).doc

章丘市社区便民市场建设项目可研55

七年级历史上册第7课铁器牛耕和社会变革学案无答案中图版

小学数学数学故事野猪上当

宽带薪酬设计20步
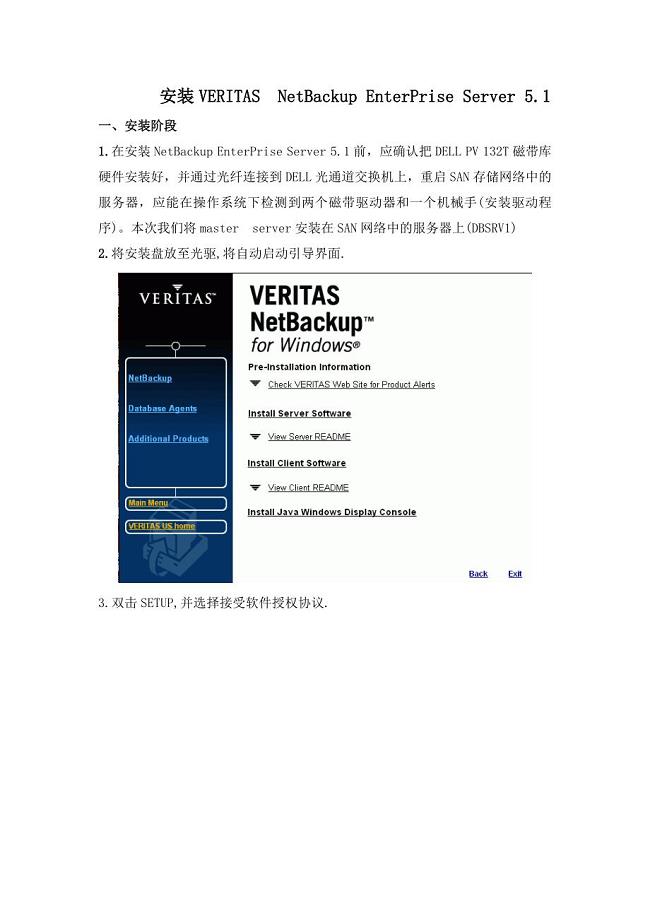
VERITAS_NetBackup安装文档

婴儿成长发育知识:四个月大的宝宝就具备“阅读”能力

计算机源代码编写规范(VB版本)

化学选修4期末易中学同步教学测试试卷

张志伟音乐《嘀哩嘀哩》教学设计方案

药品微生物检验替代方法验证操作规程

项目天棚吊顶安全性受力分析计算稿

华为桌面云解决方案设计设计

推荐师德培训心得体会集锦10篇

初中优秀作文15篇2

【精品】安徽省中考数学试卷及答案word版

400字一则的日记
某高层高支模施工方案

2022年高中英语教师培训心得体会

目标管理实施办法(DOC 7页)
 电工个人年终总结5篇
电工个人年终总结5篇
2023-04-17 10页
 2022年植树节国旗下演讲稿精选5篇范文
2022年植树节国旗下演讲稿精选5篇范文
2022-09-07 8页
 中小微企业发展情况调研提纲
中小微企业发展情况调研提纲
2022-11-15 13页
 阅读:概括提炼能力(学生)模板
阅读:概括提炼能力(学生)模板
2023-06-07 8页
 关于银行柜员职等述职报告模板锦集十篇
关于银行柜员职等述职报告模板锦集十篇
2023-08-15 29页
 (完整word版)环境保护概论试题(含答案)整合(word文档良心出品)
(完整word版)环境保护概论试题(含答案)整合(word文档良心出品)
2022-10-25 30页
 遵守交通预防溺水主题班会
遵守交通预防溺水主题班会
2023-03-23 12页
 2020年专业技术继续教育答案
2020年专业技术继续教育答案
2022-09-10 26页
 毕业典礼老师致辞精选5篇
毕业典礼老师致辞精选5篇
2023-06-26 13页
 父母课堂心得体会
父母课堂心得体会
2023-02-23 36页

