
无机材料科学基础习题与解答12
54页1、第三章 晶体结构,习题与解答3-1 名词解释(a)萤石型和反萤石型(b)类质同晶和同质多晶(c)二八面体型与三八面体型(d)同晶取代与阳离子交换(e)尖晶石与反尖晶石答:(a)萤石型:CaF2型结构中,Ca2+按面心立方紧密排列,F- 占据晶胞中全部四面体空隙。反萤石型:阳离子和阴离子的位置与 CaF2型结构完全相反,即碱金 属离子占据F-的位置,O2-占据Ca2+的位置。(b)类质同象:物质结晶时,具晶体结构中部分原有的离子或原子位置被性质相似的其它离子或原子所占有, 共同组成均匀的、 呈单一相的晶体,不引起键性和晶体结构变化的现象。同质多晶: 同一化学组成在不同热力学条件下形成结构不同的晶体的现象。(c)二八面体型:在层状硅酸盐矿物中,若有三分之二的八面体空隙被阳离子所填充称为二八面体型结构三八面体型: 在层状硅酸盐矿物中, 若全部的八面体空隙被阳离子所填充称为三八面体型结构。(d)同晶取代:杂质离子取代晶体结构中某一结点上的离子而不改变晶体结构类型的现象。阳离子交换:在粘土矿物中,当结构中的同晶取代主要发生在铝氧层 时,一些电价低、半径大的阳离子(如 K+、Na+等)将进入晶体结
2、 构来平衡多余的负电荷,它们与晶体的结合不很牢固,在一定条件下 可以被其它阳离子交换。(e)正尖晶石:在AB2O4尖晶石型晶体结构中,若A2+分布在四面体空隙、而B3+ 分布于八面体空隙,称为正尖晶石;反尖晶石:若A2+分布在八面体空隙、而 B3+一半分布于四面体空隙另一半分布于八面体空隙,通式为B(AB)O4 ,称为反尖 晶石。3-2 (a)在氧离子面心立方密堆积的晶胞 中,画出适合氧离子位置的间隙类型及位 置,八面体间隙位置数与氧离子数之比为若 干?四面体间隙位置数与氧离子数之比又 为若干?(b)在氧离子面心立方密堆积结构中,对 于获得稳定结构各需何种价离子,其中:(1)所有八面体间隙位置均填满;(2)所有四面体间隙位置均填满;(3)填满一半八面体间隙位置;(4)填满一半四面体间隙位置并对每一种堆积方式举一晶体实例说明之。解:(a)参见2-5题解答。(b)对于氧离子紧密堆积的晶体,获得稳 定的结构所需电价离子及实例如下:(1)填满所有的八面体空隙,2价阳离子,MgO;(2)填满所有的四面体空隙,1价阳离子,Li2O;(3)填满一半的八面体空隙,4价阳离子,TiO2;(4)填满一半的
3、四面体空隙,2价阳离子,ZnO02-半径为0.140nm,计3-3 MgO晶体结构,Mg2+半径为0.072nm,算MgO晶体中离子堆积系数(球状离子所占据晶胞的体积分数); 计算MgO的密度。解:参见2-9题。3-4 Li20晶体,Li+的半径为0.074nm, 02-的半径为0.140nm,其密度为1.646g/cm3,求晶胞常数a0;晶胞中Li20的分子数。解:按照已知密度计算:a =海不而询丽丽否氤)=494 *10Rc掰)=0.494W根据已知离子半径计算:Li04的棱为小立方体的面对角线。从图3-1所示尺寸关系知道:孚斯-卜十%y -偿白尸=(r力0) QV0将已知数值代入上式并解方程得:八:1.+,I 一二一 1.山|23-5试解释(a)在AX型晶体结构中,NaCl型结构最多;(b) MgAl2O4晶体结构中,按r+/r-与CN关系,Mg2+、A13+都填 充八面体空隙,但在该结构中 Mg2+进入四面体空隙,A13+填充八面 体空隙;而在MgFe2O4结构中,Mg2+填充八面体空隙,而一半Fe3+ 填充四面体空隙。(c)绿宝石和透辉石中Si:O都为1:3,前者为环状结构,
4、后者为链 状结构。答:(a)在AX型晶体结构中,一般阴离子 X的半径较大,而阳离 子A的半径较小,所以X做紧密堆积,A填充在其空隙中。大多数 AX型化合物的r+/r-在0.4140.732之间,应该填充在八面体空隙, 即具有NaCl型结构;并且NaCl型晶体结构的对称性较高,所以AX 型化合物大多具有NaCl型结构。(b)按照阳、阴离子半径比与配位数之间的关系,A13+与Mg2+的配位数均应该为6,填入八面体空隙。但是,根据鲍林规则,高电价 离子填充于低配位的四面体空隙时,排斥力要比填充八面体空隙中较 大,稳定性较差,所以Al3+填入八面体空隙,而Mg2+填入四面体空 隙。而在MgFe2O4结构中,由于Fe3+的八面体才1位能为0,可以进入四 面体或八面体空隙,当配位数为4时,Fe3+离子半径0.049nm, Mg2+ 离子半径0.057nm, Fe3+在四面体空隙中更加稳定,所以 Mg2+填充 八面体空隙、一半Fe3+填充四面体空隙。(c)绿宝石和透辉石中Si:O都为1:3。但是,绿宝石中的其它阳离 子Be2+和A13+的离子半径较小,配位数较小(4或6),相互间斥 力较大,所以绿宝
《无机材料科学基础习题与解答12》由会员cn****1分享,可在线阅读,更多相关《无机材料科学基础习题与解答12》请在金锄头文库上搜索。

庄河市关于成立群众体育消费公司分析报告模板范文

关于开学第一课观后感范文通用5篇

(多篇)2023年竞选班干部演讲稿通用15篇

赣州市文明礼仪竞赛知识

2023年反恐应急预案_反恐事件应急预案_2

关于大棚租赁合同范本(5篇)

公司财务管理工作制度

旅游景区安全管理

精校版北师大版八年级下册3 正方形的判定与性质一

财务的培训方案

日常管理经营部分 加盟商必读

商事留置权的解释论——以《物权法》第231条为中心

跟单员职责和工作范围

Unit 2 Is this your pencil period 2
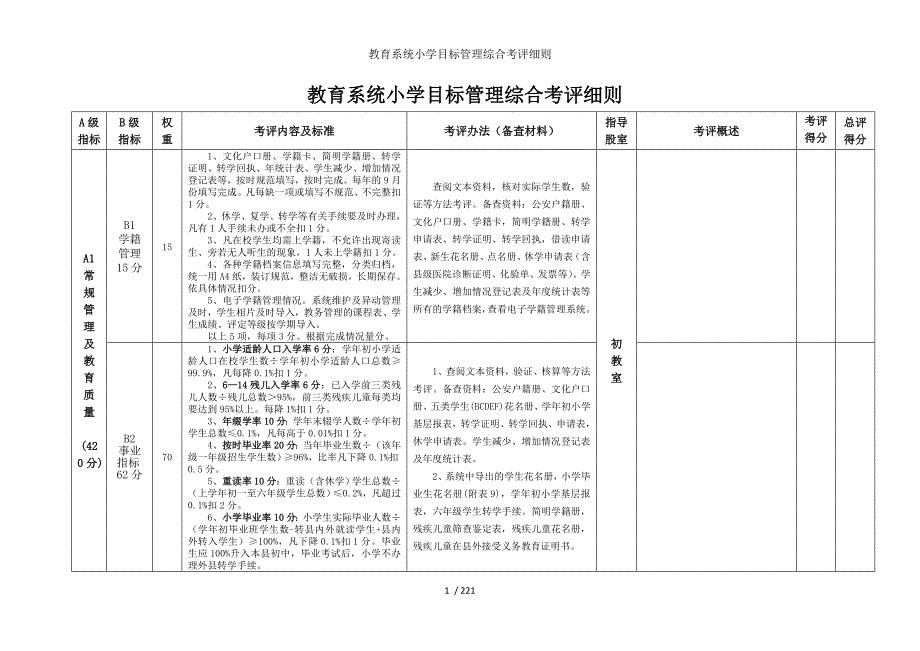
教育系统小学目标管理综合考评细则参考模板范本

大学体育教案模板排球

中国建设银行个人消费借款保证合同.doc

电子商务课程设计

二20乐曲《瑶族长鼓舞》的弹奏教案20175

商铺租赁合同协议书简洁版(4篇).doc
 《计算机应用基础》(周南岳)——第六章 多媒体软件应用
《计算机应用基础》(周南岳)——第六章 多媒体软件应用
2024-01-03 16页
 Sobolev空间的建立
Sobolev空间的建立
2023-07-25 7页
 透镜成像规律口诀法
透镜成像规律口诀法
2023-03-30 2页
 Java反射机制总结
Java反射机制总结
2024-01-15 11页
 交通安全事故应急预案
交通安全事故应急预案
2022-09-21 28页
 电磁阀基本特性与相关参数
电磁阀基本特性与相关参数
2024-01-01 3页
 群体的力量
群体的力量
2022-08-29 3页
 项目申请报告格式内容
项目申请报告格式内容
2023-02-01 5页
 肺癌中医治疗方法一
肺癌中医治疗方法一
2022-12-28 1页
 电路图上的常见电力符号
电路图上的常见电力符号
2023-10-14 4页

