
western-blot条带分析及解决方法
6页1、现象原因解决反影(白色条带,黑色背景)1 HRP过高(背景较高)至少成倍稀释一抗/二抗(可410倍)*注1显影后膜上条带处变为黄色2 HRP过高(敏感性太高)至少成倍稀释一抗/二抗(可410倍)*注2信号弱或无3 HRP过高引起底物迅速耗竭至少成倍稀释一抗/二抗(可410倍)*注34抗体-抗原系统敏感性过低提高抗体浓度/蛋白上样量*注45转膜不充分/过转优化转膜条件*注56 HRP或底物活性降低测试活性或选用敏感底物*注6咼背景7 HRP过高(背景较高)至少成倍稀释一抗/二抗(可410倍)*注78封闭时间不足延长封闭时间4度过夜最好*注89抗体与封闭液有父叉更换封闭液(如3%BSA的TBST)*注910 TBST洗脱不足增加洗脱时间、次数、用量*注1011暴光时间过长降低暴光时间*注1112抗原-抗体浓度过高降低抗体浓度或蛋白上样量*注12条带内无显影的白点13转膜不良(如有气泡在胶-膜之间)精细操作*注1314膜平衡不均/油脂污染按说明书平衡膜/戴手套用平头镊子持膜*注1415膜与X光片间有气泡显影前去除气泡*注15非特异性条带16抗体父叉反应至少成倍稀释一抗/二抗(可410倍)*注
2、1617 SDS非特异性结合蛋白条带使用无SDS转膜液*注17散在小圆斑18封闭液有杂质颗粒静置牛奶使大颗粒沉淀,仅用上层*注18*注 1其具体问题有二:一是背景较高,二是没有条带形成机制为条带处HRP很快将底物耗竭,则不发光不使胶片感光而为白色周围因背景HRP较低而持续发光一段时间使胶片感光为黑色。这种常见于高浓度抗体并且封闭/洗脱不好的情况下。如果没有背景则就是原因3的现象。在暗室可以看到条带周围荧光而条带处为暗。如是则要么通过降低抗体解决,要么动作迅速早期未耗竭底物时压片,否则一旦耗竭通过减少压片时间不能解决问 题。也可以过一段时间鼿 RP 稍减后重加底物迅速压片。还有另外一种反影现象就是压出条带粗大模糊,但条带中心是空的白色,原因和上面的 一样,主要是条带中心耗竭底物引起的,也可以在暗室看到中空的荧光带,但与上面的区别主要在于特异性要好一些,若继续发展则就是原因3 的现象。其分析和解决同上。*注2其原因主要是HRP太高超速催化底物生成的产物使膜发黄,压出的片子可以是正常的或和原因1或原因3的现象同时存在,只是一种现象,在压过 的膜可以看出来(只在加底物后一段时间出现,几小时后可
3、能还会消退,有时甚至刚加底物12min就可以看出来,所以要把握时机)。如果没有 达到原因 1和原因 3的程度,那么这种情况一定能够看到很强的荧光,是一种良好的状态,是我们所期盼的。如果压出正常片子而不出现原因1和 原因3的现象,可以不予处理。但因为荧光太强极易导致条带增粗变大,所以也可以不稀释抗体而通过调整压片时间来解决,一般压10s30s,甚 至可以35s,即时根据结果在暗室调整,荧光持续时间长的话都可连续压十数张片子而效果良好。但也有这种情况,就是由于HRP过强无论怎么 减少压片时间条带都依然粗大(如果时间过短如3s则可因感光不足导致条带太淡,这样就不可取了,但依然是粗大的、非条带的本来面目)那 么如果想获得漂亮条带则必须通过降低抗体浓度(减少上样量很不稳定且能力有限,故很少使用)来解决。原因1和3若如是则解决也是一样的。*注3这是与1类似但抗体特异性较好时的一种表现,经常与下面的原因4、5、6混淆,特别需要注意。主要出现在HRP极高的情况下,来不及压片就 已耗竭底物,往往伴有原因2的现象。可通过加入底物后迅速进入暗室观察荧光确定,也可以根据原因2的现象确定,以区分于原因4、5、6
4、。 除非动作迅速早期未耗竭底物时压片,否则一旦耗竭通过减少压片时间不能解决问题。也可以过一段时间待HRP稍减后TBST简单洗膜重新加底 物压片。这种情况下一/二抗稀释可高达10倍而依然荧光明显。*注 4 提高抗体上样量以及下述的使用敏感底物/延长压片时间比较简单,在此不赘述,只提醒一下随抗体浓度增高背景和非特异性可能会增加。关于上样 量的极限在此发表我的看法:对于裂解的混合蛋白以上样孔底面积平方毫米)乘30ug作为极限上样量,而落实到每一个具体条带(同一分子量的 所有蛋白或仅做单一蛋白电泳),则以0.3ug/平方毫米底面积作为极限上样量。(见抗体技术实验指南的免疫印迹一章),超过此量可能会导致 条带变形。条带信号弱可以通过加大上样量/提高抗体浓度/使用敏感底物/延长压片时间解决。但实际上样量的极限并不以我说的极限上样量为准, 因为这个极限上样量是确保所有分子量的条带都跑的很漂亮的极限,而上样超量的表现是随量的加大变形的条带由低分子量逐渐往高分子量延伸。 所以western极限上样量的真正操作标准是以目的条带不变形作为极限。比如对于150kd,完全可以超出我所说的极限上样量的2倍而不变形
《western-blot条带分析及解决方法》由会员桔****分享,可在线阅读,更多相关《western-blot条带分析及解决方法》请在金锄头文库上搜索。

我的同桌六年级作文7篇
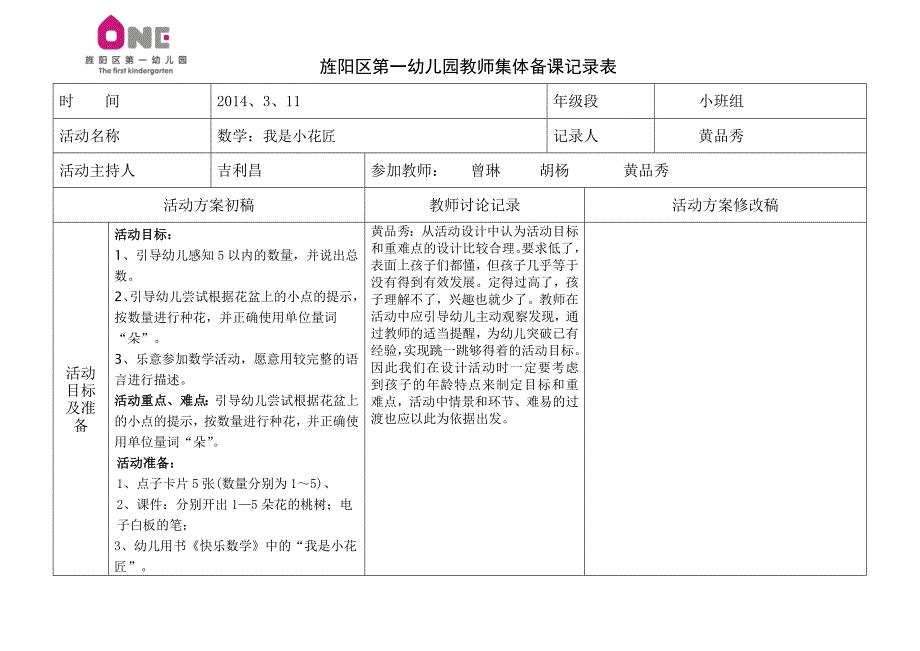
数学:花儿朵朵

外墙内保温工程施工合同

阳江电机项目商业计划书【模板范本】

《复变函数与积分变换》课后答案(华中科技(共96页)

【最新资料】江苏省镇江一中等高三下学期六校联考2月数学试卷含答案

小学班级爱国卫生月活动总结3篇

空气污染及防治教学设计

我心永恒Myheartwillgoon

小组工作安排

2021年海的女儿教学反思

河北省丰宁满族自治县窄岭中学八年级物理上册 时间、长度学案(无答案)(新版)新人教版
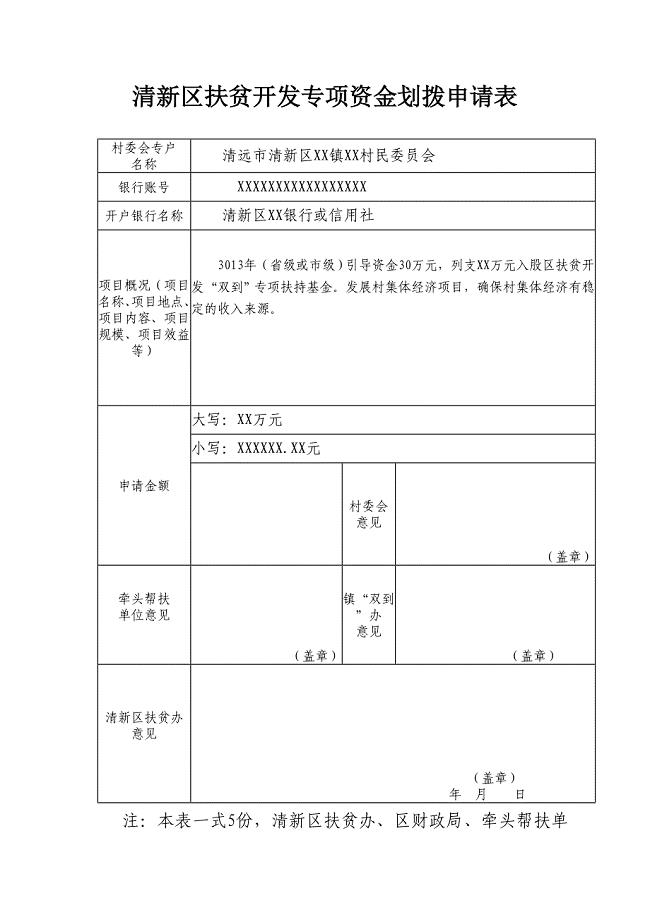
入股扶贫开发专项资金划拨申请表样板格式

200亩花卉种植基地建设可行性研究报告建议书

课堂教学三维目标的具体内容和层次划分

消防安全保卫措施和用火电制度(2篇)

土方开挖施工措施

五四红旗团支部申请材料

城乡污水处理调查报告

2023师生关系的研究开题报告
 安全文明施工监理细则(模板)
安全文明施工监理细则(模板)
2023-08-16 19页
 车辆能源消耗管理制度
车辆能源消耗管理制度
2023-05-16 16页
 刑事诉讼重点难点
刑事诉讼重点难点
2023-08-21 18页
 造纸工业使用木材
造纸工业使用木材
2023-02-02 9页
 过滤机使用说明
过滤机使用说明
2024-03-02 10页
 学习实践反思
学习实践反思
2022-11-13 20页
 地下空间的开发与利用
地下空间的开发与利用
2024-01-06 7页
 商务合作协议书范文6篇
商务合作协议书范文6篇
2023-08-06 31页
 早教机构课程顾问手册簿(11页)
早教机构课程顾问手册簿(11页)
2023-05-08 11页
 商用车车联网监控方案可行性分析报告
商用车车联网监控方案可行性分析报告
2023-04-12 17页

