
重庆一中高三上学期期中考试化学试题及答案
7页1、秘密启用前2013年重庆一中高2014级高三上期半期考试化 学 试 题2013.11本部分包括第卷(选择题)和第卷(非选择题)两部分,满分100分。可能用到的相对原子质量:H 1 O 16 Na 23 S 32 Cl 35.5 Fe 56 Cu 64第卷(选择题,共42分)单选题:每小题只有一个正确选项。6. 某合作学习小组讨论辨析以下说法:粗盐和酸雨都是混合物;荔枝酿酒和空气液化制取氮气的过程中都只发生物理变化;冰和干冰既是纯净物又是电解质;不锈钢和目前流通的硬币都是合金;盐酸和食醋既是化合物又是酸;纯碱和熟石灰都是碱;豆浆和雾都是胶体。上述说法正确的是ABCD7.下列化学用语使用正确的是AMg2+结构示意图: B质子数为92,中子数为146的U原子: CNH4Cl的电子式: D四氯化碳分子球棍模型: 8设NA为阿伏加德罗常数的值。下列说法正确的是A标准状况下,22.4 L CCl4含有CCl键的数目为4 NA B常温常压下,44 g 由N2O与CO2组成的混合气体含有的氧原子数目为NA C反应NH4N32N2+ 2H2,常温常压下每生成22.4 L N2,转移电子的数目为2 NAD
2、1 L 1 molL-1的AlCl3溶液中含有Cl的数目为3NA9能正确表示下列反应的离子方程式是AFe2O3溶于过量氢碘酸溶液中:Fe2O3 + 6H+ + 2I-=2Fe2+ + I2 +3H2OB铝粉与NaOH溶液反应:2Al + 2OH=2AlO2+ H2C5.6 g Fe与200 mL 2.0 mol/L HNO3溶液充分反应: 3Fe + 2NO3-+ 8H+3Fe2+ + 2NO + 4H2OD碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4OHNH3H2O10. 对于实验IIV的描述正确的是 A实验I :逐滴滴加稀盐酸时,试管中立即产生大量气泡B实验II:充分振荡后静置,下层溶液为橙红色,上层无色C实验III:从饱和食盐水中提取NaCl晶体D装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去11海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是A制取NaHCO3的反应是利用其溶解度小于NaClB用澄清的石灰水可鉴别NaHCO3和Na2CO3C在第、步骤中,溴元素均被氧化D工业上通过电解饱和MgCl2溶液制
3、取金属镁12. 短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是A原子半径的大小顺序:rZrYrXB氢化物的稳定性强弱顺序:XH4YH3HWCY的氢化物与W的氢化物化合所得产物中只含有共价键DX、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应第卷(非选择题,共58分)8(14分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在110nm之间)下图所示AE为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题(1)实验室制备NH3的反应方程式:_;(2)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接 , 接 , 接h;(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,试写出制纳米级碳酸钙的离子方程式 ;(4)在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)_,(5)取反应后去除了CaCO3的溶液分别做以下实验,下列实验判断
《重庆一中高三上学期期中考试化学试题及答案》由会员工****分享,可在线阅读,更多相关《重庆一中高三上学期期中考试化学试题及答案》请在金锄头文库上搜索。

暑期实践实习报告范文集合5篇
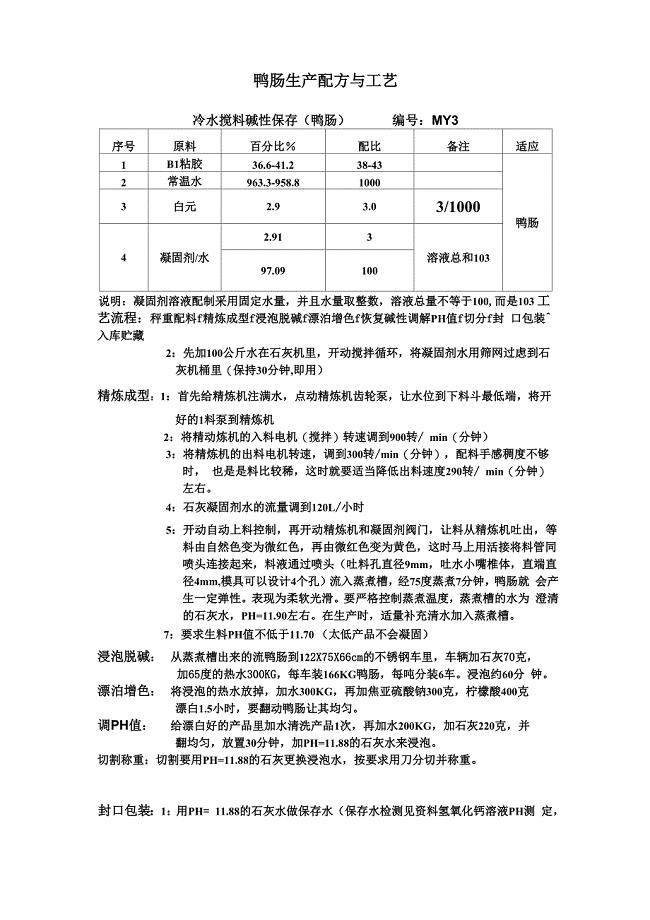
鸭肠生产配方与工艺

第一季度学校工作总结报告(共3篇)

中国医科大学21秋《康复护理学》在线作业一答案参考13

韩语培训行业调查报告

研学旅行活动方案

西安应急救援装备项目建议书(范文)

精选类八年级生物上册5.5.1细菌和真菌在自然界中的作用学案人教新课标版通用

政治教师工作收获总结(2篇).doc

2023年甘肃省白银市平川区宝积镇尖山村社区工作人员考试模拟题含答案

二年级家长会班主任发言稿8

高一英语第1次月考

医院急诊科工作总结范文(4篇).doc

工程高质量创优方案设计

2022年公司文员工作计划

某改建工程的加固设计与施工探讨(发表版)

责任与贡献师德演讲稿范文

基于plc的自动售货机的设计毕业(设计)论文正文

2022年小学生写人作文600字3篇【模板】

标准化监督检查制度
 XX民政局减灾救灾“十三五”发展规划与市委组织部办公室副主任述职述廉述德报告合集
XX民政局减灾救灾“十三五”发展规划与市委组织部办公室副主任述职述廉述德报告合集
2023-07-13 7页
 建筑外墙涂料施工常见质量通病的防治措施
建筑外墙涂料施工常见质量通病的防治措施
2022-09-18 3页
 (模板)2023年初中学生违纪检讨书
(模板)2023年初中学生违纪检讨书
2023-08-17 14页
 GMAT资料GWDTN16
GMAT资料GWDTN16
2022-10-25 16页
 医院后勤工作管理制度
医院后勤工作管理制度
2024-02-16 20页
 2023年精选公司委托书模板锦集九篇
2023年精选公司委托书模板锦集九篇
2022-09-09 7页
 小学六年级家长会班主任发言稿 (19)
小学六年级家长会班主任发言稿 (19)
2023-11-02 13页
 个人借款合同范文汇总9篇(范本精选).doc
个人借款合同范文汇总9篇(范本精选).doc
2023-06-14 134页
 (实用)2023年除夕活动策划15篇
(实用)2023年除夕活动策划15篇
2024-03-06 50页
 (word版)2022年会计辞职报告模板集锦9篇
(word版)2022年会计辞职报告模板集锦9篇
2024-01-25 16页

