
2022化学2022高考化学专题复习导练测 第六章 第1讲 化学反应的热效应
168页1、 第六章化学反应与能量第六章化学反应与能量第第1讲化学能与热能讲化学能与热能1.明白化学反应中能量转化的缘由,能说出常见的能量转化形式;2.明白化学能与热能的相互转化,明白吸热反应,放热反应,反应热等概念;3.明白热化学方程式的含义;4.明白能源是人类生存和社会进展的重要基础,明白化学在解决能源危机中的重要作用;5.明白焓变与反应热的含义;明白HH(反应产物)H(反应物)表达的含义;6.懂得盖斯定律,并能运用盖斯定律进行有关反应焓变的简洁运算;考纲要求考纲要求剖析题型 提炼方法考点一考点一 焓变与反应热焓变与反应热考点二考点二 热化学方程式热化学方程式探究高考明确考向探究高考明确考向练出高分练出高分考点三考点三 两类重要反应热两类重要反应热 燃烧热,中和热燃烧热,中和热考点四考点四 有关反应热的比较,运算有关反应热的比较,运算考点五考点五 能源能源学问学问梳理梳理递进递进题组题组考点一焓变与反应热考点一焓变与反应热学问梳理学问梳理1.化学反应中的能量变化(1)化学反应中的两大变化:变化和变化;(2)化学反应中的两大守恒:守恒和守恒;(3)化学反应中的能量转化形式:,光能,电能等;通常主
2、要表现为的变化;2.焓变,反应热(1)定义:在条件下进行的反应的;(2)符号:;(3)单位:或;物质能量质量能量热能热量恒压热效应HkJmol1kJ/mol3.吸热反应和放热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示;吸放(2)从反应热的量化参数键能的角度分析(3)记忆常见的放热反应和吸热反应放热反应:可燃物的燃烧;酸碱中和反应;大多数化合反应;金属跟酸的置换反应;物质的缓慢氧化等;吸热反应:大多数分解反应;盐的水解和弱电解质的电离;Ba(OH)28H2O与NH4Cl反应;碳和水蒸气,C和CO2的反应等;深度摸索深度摸索判定正误,正确的划“”,错误的划“”(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应()(2)物质发生化学变化都伴有能量的变化()(3)伴有能量变化的物质变化都是化学变化()(4)吸热反应在任何条件都不能发生()(5)Na转化为Na时,吸取的能量就是该过程的反应热()解析是物理变化过程,其能量变化不能称为反应热;解析是物理变化过程,其能量变化不能称为反应热;(6)水蒸气变为液态水时放出的能量就是该变化的反应热()(7)同温同压下,反应H2(
3、g)Cl2(g)=2HCl(g)在光照和点燃条件下的H不同()解析焓变与反应条件无关;(8)可逆反应的H表示完全反应时的热量变化,与反应是否可逆无关()解析是物理变化过程,其能量变化不能称为反应热;解析是物理变化过程,其能量变化不能称为反应热;递进题组递进题组题组一依据图形,理清活化能与焓变的关系题组一依据图形,理清活化能与焓变的关系1.某反应过程中体系的能量变化如以下图,以下说法错误选项()A.反应过程可表示为ABCABCABC(反应物)(过渡态)(生成物)B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能C.正反应的热效应HE1E20,所以正反应为放热反应D.此图中逆反应的热效应HE1E20,所以逆反应为放热反应解析该图表示的正反应放热,H为负值,逆反应吸热,H为正值,D错误;答案D2.(2021海南,1改编)某反应的H100kJmol1,以下有关该反应的表达正确选项()A.正反应活化能小于100kJmol1B.逆反应活化能确定小于100kJmol1C.正反应活化能不小于100kJmol1D.正反应活化能比逆反应活化能小100kJmol1解析某反应的解析某反应的H100
4、kJmol1,说明该反应的正反,说明该反应的正反应为吸热反应,且正反应的活化能比逆反应的活化能大应为吸热反应,且正反应的活化能比逆反应的活化能大100 kJmol1,正反应的活化能应大于,正反应的活化能应大于100 kJmol1,无法确,无法确定逆反应的活化能大小;定逆反应的活化能大小;答案答案C正确懂得活化能与反应热的关系正确懂得活化能与反应热的关系练后反思练后反思1.催化剂能降低反应所需活化能,但不影响焓变的大小;2.在无催化剂的情形,E1为正反应的活化能,E2为逆反应的活化能,即E1E2|H|;题组二依据共价键数,利用键能运算反应热题组二依据共价键数,利用键能运算反应热3.已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量;其他相关数据如下表:就表中x为()A.920B.557C.436D.188解解 析析 依依 据据 题题 意意,可可 得得 热热 化化 学学 方方 程程 式式 为为 2H2(g)O2(g)=2H2O(l)H572 kJmol1;而而18 g水水蒸蒸气气变变成成液液态态水水时时放放出出44 kJ热热量量,就就2H2(g)O
5、2(g)=2H2O(g)H484 kJmol1,即即484 kJ2x496 kJ4463 kJ,解得,解得x436 kJ;答案答案C4.通常把拆开1mol某化学键所吸取的能量看成该化学键的键能;键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(H),化学反应的H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差;下面列举了一些化学键的键能数据,供运算使用;工业上的高纯硅可通过以下反应制取:SiCl4(g)2H2(g)=Si(s)4HCl(g),该反应的反应热H为_;解析SiCl4,H2和HCl分子中共价键的数目简洁运算,而产物硅属于原子晶体,可依据原子晶体的结构运算晶体硅中的共价键的数目;1mol晶体硅中所含的SiSi键为2mol,即制取高纯硅反应的反应热H4360 kJmol12436 kJmol1(2176kJmol14431kJmol1)236kJmol1;236kJmol11.熟记反应热H的基本运算公式H生成物的总能量反应物的总能量H反应物的总键能之和生成物的总键能之和2.规避两个易失分点(1)旧化学键的断裂和新化学键的形成是同时进行的,缺少任何一个
《2022化学2022高考化学专题复习导练测 第六章 第1讲 化学反应的热效应》由会员橙**分享,可在线阅读,更多相关《2022化学2022高考化学专题复习导练测 第六章 第1讲 化学反应的热效应》请在金锄头文库上搜索。

2023-2024学年广东省中山市小学语文四年级期末模考试题详细参考答案解析

2023-2024学年山东省初中生物九年级期末模考考试题详细答案和解析

2023-2024学年湖南省韶山市小学语文四年级期末点睛提升考试题详细参考答案解析
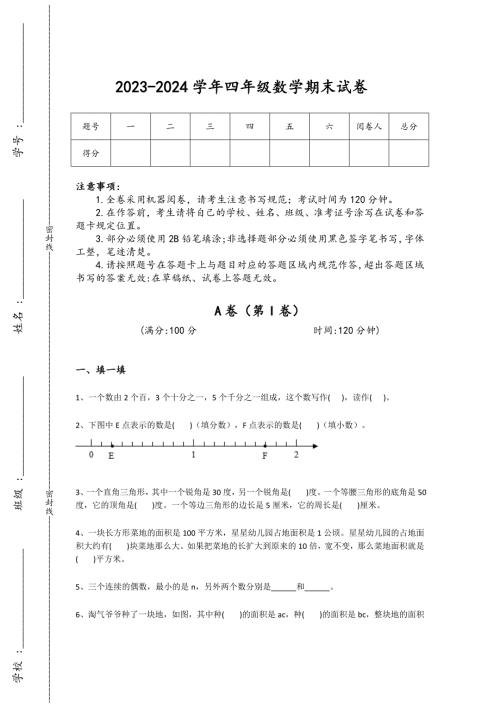
2023-2024学年山西省小学数学四年级期末通关提分卷详细答案和解析

2023-2024学年四川省泸州市初中物理九年级期末高分通关题详细答案和解析
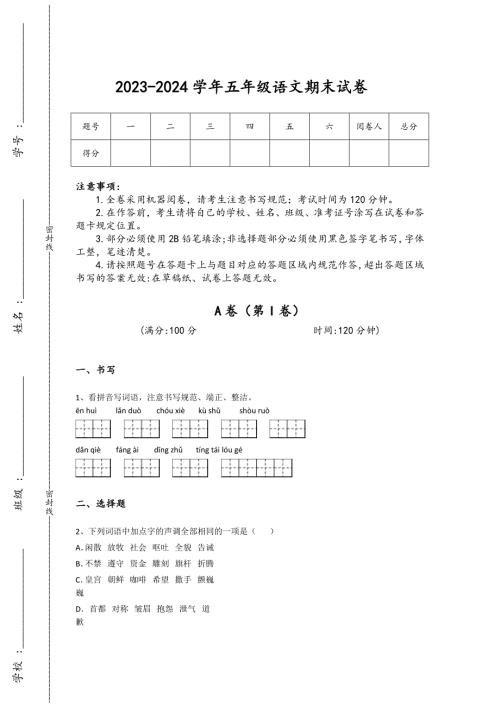
2023-2024学年湖北省咸宁市小学语文五年级期末自测模拟考试题详细参考答案解析

2023-2024学年河南省林州市初中物理八年级期末深度自测试卷详细答案和解析
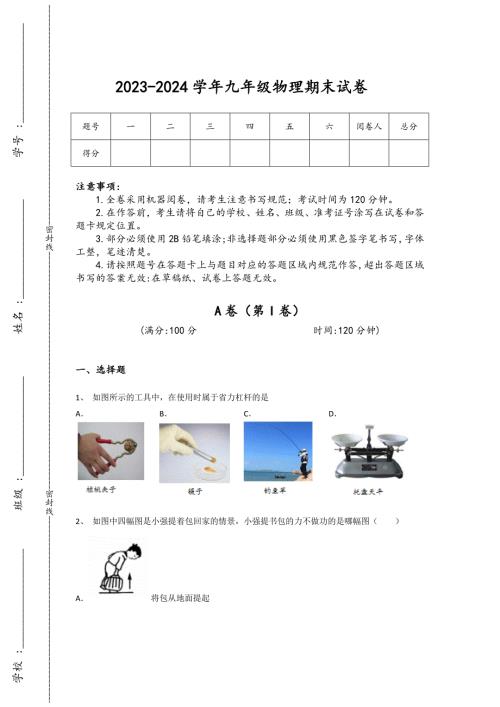
2023-2024学年辽宁省初中物理九年级期末通关提分卷详细答案和解析

2023-2024学年河北省张家口市初中物理九年级期末评估试题详细答案和解析

2023-2024学年江苏省扬州市初中物理九年级期末模考试卷详细答案和解析

2023-2024学年江苏省常州市初中物理九年级期末通关预测题详细答案和解析

宴会复习题带答案版1英语基础

高考物理一轮复习 专题33 水平面内的圆周运动练习含解析新人教版新人教版高三全册物理试题试题

高考物理一轮复习 专题50 光电效应 波粒二象性测含解析人教版高三全册物理试题1高中教育

高考政治“文化生活”复习提纲高考

高考数学总复习资料1高考

一年级下册语文课文内容填空复习题小学教育

C复习题全部答案C资料

八年级数学第六章《一次函数》单元复习中学

医疗纠纷复习题案例分析案例
 2022九年级语文下学期期中综合检测卷习题课件 新人教版
2022九年级语文下学期期中综合检测卷习题课件 新人教版
2024-05-22 34页
 2021年普通高等学校招生全国统一考试理综试题(全国甲卷无答案)
2021年普通高等学校招生全国统一考试理综试题(全国甲卷无答案)
2024-05-22 12页
 黑龙江省大庆市2021-2022学年高一政治下学期期中试题
黑龙江省大庆市2021-2022学年高一政治下学期期中试题
2024-05-22 9页
 黑龙江省大庆市2021-2022学年高一化学下学期期中试题
黑龙江省大庆市2021-2022学年高一化学下学期期中试题
2024-05-22 12页
 黑龙江省大庆市2021-2022学年高一历史下学期期中试题
黑龙江省大庆市2021-2022学年高一历史下学期期中试题
2024-05-22 11页
 黑龙江省大庆市2021-2022学年高一物理下学期期中试题
黑龙江省大庆市2021-2022学年高一物理下学期期中试题
2024-05-22 11页
 黑龙江省大庆市2021-2022学年高一地理下学期期中试题
黑龙江省大庆市2021-2022学年高一地理下学期期中试题
2024-05-22 9页
 2022八年级语文下学期期中综合检测卷习题课件 新人教版
2022八年级语文下学期期中综合检测卷习题课件 新人教版
2024-05-22 46页
 2022七年级科学上册 第1章 科学入门 1.5科学探究习题课件 (新版)浙教版
2022七年级科学上册 第1章 科学入门 1.5科学探究习题课件 (新版)浙教版
2024-05-22 26页
 2022七年级科学上册 第1章 科学入门 1.4科学测量第2课时习题课件 (新版)浙教版
2022七年级科学上册 第1章 科学入门 1.4科学测量第2课时习题课件 (新版)浙教版
2024-05-22 28页

