
GMP验证方式的分类及概念
11页1、验证方式的分类及概念第一节名词解释一、空调净化系统/HVAC是HeatingVentilationandAirConditioning的评点。二、挑战性试验/Challengetest旨在确定某一个工艺过程或一个系统的某一组件,如一个设备、一个设施在设定的苛刻条件下能否确保达到预定的质量要求的试验。加干热灭菌程序验证过程中,在侍灭菌的玻璃瓶中,人为地加入一定量的内毒素,按设定的程序灭菌,然后检查内毒素的残留量,以检查灭菌程序能否确实达到了设定的要求。又如,为了验证无菌过滤器的除菌能力,常以每cm2滤膜能否滤除107的缺陷假单孢菌的技术要求来进行过滤试验。三、最差状况/Worstcase系指导致工艺及产品失败的几率比正常工艺条件高很多的工艺条件或状态。四、不合格限/Edge-of-failure指工艺的一个控制参数的值,工艺运行超过这一值的后果将是工艺失控,产品不合格。五、验证方案/ValidationProtocol指为实施验证而制定的-套包括待验证科目(系统、设备或工艺)、目的、范围、标准、步骤、记录、结果、评价及最终结论在内的文件。六、在线清洗/CIPCleaninginplace
2、的译意,指系统或设备在原安装位臵不作任何移动条件下的清洗工作。七、在线灭菌/SIPSterilizationinplace的译意,常指系统或设备在原安装位臵不作任何移动条件下的蒸汽灭菌。八、预确认/Prequalification即设计确认,通常指对待订购设备技术指标适用性的审查及对供应厂商的选定。九、安装确认/Installationqualification(IQ)主要指机器设备安装后进行的各种系统检查及技术资料的文件化工作。十、运行确认/Operationalqualification(OQ)为证明设备达到设定要求而进行的运行试验。十一、性能确认/Performancequalification常指模拟生产试验。十二、产品验证/Productvalidation指在特定监控条件下的试生产。十三、工艺验证/processvalidation也可译作过程验证、指与加工产品有关的工艺过程的验证。十四、合格证明/Certification常指某一机器设备、设施安装后进行的检查和运行或某项工艺的运行达到设计要求而准予合格。十五、前验证/Prospectivevalidation系指一项工艺
3、、一个过程、一个系统、一个设备或一种材料在正式投入使用前进行的,按照设定的验证方案进行的验证。十六、同步验证/Concurrentvalidation指生产中在某项工艺运行的同时进行的验证,即从工艺实际运行过程中获得的数据来确立文件的依据、以证明某项工艺达到预定要求的活动。十七、回顾性验证/Rebosp06YGvaIida60n指以历史数据的统计分析为并础的旨在证实正式生产工艺条件适用性的验证。十八、再验证/Revalidation系指一项工艺、一个过程、一个系统、一个设备或一种材料经过验证并在使用一个阶段以后进行的,旨在证实已验证状态没有发生飘移而进行的验证。关键工序往往需要定期进行再验证。第二节验证的定义及概念WH01992年版的GMP对验证作了如下的定义:验证系指能证实任何程序、生产过程、设备、物料、活动或系统确实能导致预期结果的有文件证明的行为。美国FDA在1983年3月29日公布的生产验证总原则草案中曾把工艺验证定义为:一个有文件和记录的方案,它能使一项专门的工艺过程确实始终如一地生产出符合预定规格及质量标准的产品。从上面的定义可以看出,验证涉及药品生产的各个方面。它包括了影
4、响药品质量的各种因素。本书将要讨论的验证的内容除包括制剂和包装主体的各单元作业(如混气、干燥、压片、包衣、充填、配制、灌封、灭菌、贴签等作业)外、还包括介质(如水、压缩空气、氮气)、厂房、设备、规程(如检验方法、清洁规程)、计算机系统及原料药生产等。因此,本书取名药品生产验证指南。在制定验证方案、实施验证过程中,药厂碰到的-个重要问题是如何确定待验证项目的内容,如何设定待验证参数的范围。这样也就有必要进-步弄清验证的概念,弄清工艺开发和工艺验证这二者的关系及区别。工艺开发和工艺验证是产品开发过程中两个不同的工作阶段。工艺开发是工艺验证的前提,工艺验证则是产品开发的最后一道工序。二者最终的质量目标是一致的,但它们的阶段目标显然各不相同。工艺开发是配方和工艺条件的优选试验,而工艺验证则以工艺的可靠性和重现性为目标,即在实际的生产设备和工艺卫生条件下,用试验来证实所设定的工艺路线和控制参数能够确保产品的质量,它通常不包括条件优选试验。例如,一个灭菌程序,对最终灭菌产品而言,应确保产品达到USP标准Fo8的要求,没有什么条件优化问题要加以考虑。在不同的装载方式条件下,确保灭菌釜冷点达到药典规定
《GMP验证方式的分类及概念》由会员大米分享,可在线阅读,更多相关《GMP验证方式的分类及概念》请在金锄头文库上搜索。

经济类实习报告汇总五篇

某机车车辆有限公司薪酬激励问题研究论文

商场营销实习个人报告总结(二篇).doc

建设中高档童车及儿童玩具生产线项目建议书写作模板

2021年公司出纳个人工作计划与2021年公司前台下半年工作计划范文

7S标准实训管理手册

高中数学知识点总结

财务个人年终工作总结报告(2篇).doc

感恩教育广播稿

套房出租合同书律师版(5篇)

新版西工大附中高考数学理模拟题含答案(四)
分数混合运算

无氯氟聚氨酯项目申请报告写作参考模板

2023年食品卫生责任制度6篇

学前班数学期末考试卷1、2

如何快速预测新股上市首日是否具有短线机会

2023年06月云南省药品监督管理局机关服务中心招考聘用劳务派遣人员笔试题库含答案附带解析
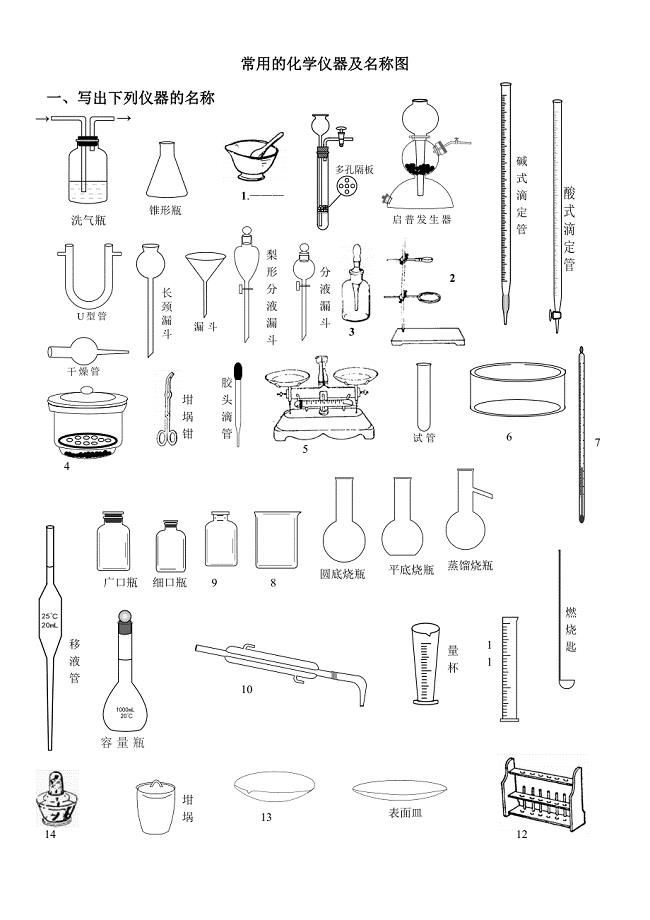
常用的化学仪器及名称图

2012年中考复习化学图像专题

树脂瓦板房建筑施工合同
 稀土元素的化学反应
稀土元素的化学反应
2023-07-09 6页
 小学语文个性化作业设计案例(1)
小学语文个性化作业设计案例(1)
2023-02-15 2页
 因法院执行疏忽造成执行人损失如何处理-法律常识
因法院执行疏忽造成执行人损失如何处理-法律常识
2022-10-13 1页
 “两个责任”的具体内容
“两个责任”的具体内容
2022-10-04 4页
 2021年公司出纳个人工作计划与2021年公司前台下半年工作计划范文
2021年公司出纳个人工作计划与2021年公司前台下半年工作计划范文
2022-10-01 4页
 水泥硫碱比的计算方法
水泥硫碱比的计算方法
2023-08-02 5页
 加盟合同(日式中心加盟店)律师拟定版本0001.docx
加盟合同(日式中心加盟店)律师拟定版本0001.docx
2022-11-14 8页
 教学反思的实质.docx
教学反思的实质.docx
2023-09-28 2页
 技嘉GAH61MDS2(rev.3.0)主板性能如何
技嘉GAH61MDS2(rev.3.0)主板性能如何
2022-07-30 2页
 九年级英语期末定稿
九年级英语期末定稿
2022-08-10 17页

