
【精品】鲁科版选修四课时训练【2】热化学方程式反应焓变的计算含答案
6页1、精品化学教学资料课时训练2热化学方程式反应焓变的计算一、单项选择题1.今有如下三个热化学方程式:H2(g)+O2(g)H2O(g)H=a kJmol-1H2(g)+O2(g)H2O(l)H=b kJmol-12H2(g)+O2(g)2H2O(l)H=c kJmol-1下列关于它们的表述正确的是()。A.它们都是吸热反应B.a、b和c均为正值C.a=bD.2b=c解析:根据热化学方程式书写中反应热表示方法的规定即H为“-”表示放热,H为“+”表示吸热,可判断H2燃烧放出的热量应用负值表示,因为燃烧反应为放热反应,故A、B错;根据相同物质的反应,聚集状态不同,反应热不同可判断ab,故C错;根据相同反应,反应热与可燃物的物质的量成正比可判断2b=c。答案:D2.已知299 K时,合成氨反应N2(g)+3H2(g)2NH3(g)H=-92.0 kJmol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)()。A.一定小于92.0 kJB.一定大于92.0 kJC.一定等于92.0 kJD.无法确定解析
2、:反应热是指反应完全进行时放出或吸收的热量。1 mol N2和3 mol H2放在密闭容器中,在催化剂存在时进行的反应为可逆反应,是不能进行到底的,因此反应放出的热量一定小于92.0 kJ。答案:A3.已知:1 mol H2分子中化学键断裂时需要吸收436 kJ的能量1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量下列叙述正确的是()。A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)2HCl(g)B.氢气和氯气反应生成2 mol氯化氢气体,反应的H=183 kJ mol-1C.氢气和氯气反应生成2 mol氯化氢气体,反应的H=-183 kJ mol-1D.氢气和氯气反应生成1 mol氯化氢气体,反应的H=-183 kJ mol-1解析:反应可表示为HH+ClCl2HCl,可知断裂了1 mol HH键和1 mol ClCl键,同时生成了2 mol HCl键。根据反应热与键能的关系:H=E(反应物)-E(生成物)=(436 kJmol-l+243 kJmol-1)-2431 kJmol
3、-1=-183 kJmol-1。正确的热化学方程式是H2(g)+Cl2(g)2HCl(g)H=-183 kJmol-1,表明1 mol H2与1 mol Cl2反应生成2 mol氯化氢时放出183 kJ的热量。答案:C4.根据碘与氢气反应的热化学方程式(i)I2(g)+ H2(g)2HI(g)+ 9.48 kJ(ii)I2(s)+ H2(g)2HI(g)-26.48 kJ下列判断正确的是()。A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJB.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJC.反应(i)的产物比反应(ii)的产物稳定D.反应(ii)的反应物总能量比反应(i)的反应物总能量低答案:D5.已知:CH3CH2CH2CH3(g)+6.5O2(g)4CO2(g)+5H2O(l)H=-2 878 kJmol-1(CH3)2CHCH3(g)+6.5O2(g)4CO2(g)+5H2O(l)H=-2 869 kJmol-1下列说法正确的是()。A.正丁烷分子储存的能量大于异丁烷分子B.正丁烷的稳定性大于异丁烷C.异丁烷转化为正丁烷的过程是一个放
4、热过程D.异丁烷分子中的碳氢键比正丁烷的多解析:本题考查化学反应中的能量变化。从反应方程式可以看出,在同样的条件下,正丁烷放热比异丁烷多,故A正确;物质的能量越高越不稳定,因此稳定性异丁烷大于正丁烷,故B错;异丁烷转化为正丁烷能量增多,因此是一个吸热过程,故C错;由烃的结构特点可知氢原子数相同,两者碳氢键个数必相等,故D错。答案:A6.已知:2C(s)+O2(g)2CO(g)H=-221.0 kJmol-12H2(g)+O2(g)2H2O(g)H=-483.6 kJmol-1则制备水煤气的反应C(s)+H2O(g)CO(g)+H2(g)的H为()。A.+262.6 kJmol-1B.-131.3 kJmol-1C.-352.3 kJmol-1D.+131.3 kJmol-1解析:据盖斯定律,把已知两个反应相加减,可求得制备水煤气反应的H。由-得2C(s)+O2(g)-2H2(g)-O2(g)2CO(g)-2H2O(g)H=-221.0 kJmol-1-(-483.6 kJmol-1),即2C(s)+2H2O(g)2H2(g)+2CO(g)H=+262.6 kJmol-1,则C(s)+H
《【精品】鲁科版选修四课时训练【2】热化学方程式反应焓变的计算含答案》由会员博****1分享,可在线阅读,更多相关《【精品】鲁科版选修四课时训练【2】热化学方程式反应焓变的计算含答案》请在金锄头文库上搜索。

三年级上册数学教案第4单元第1课时三位数加三位数1
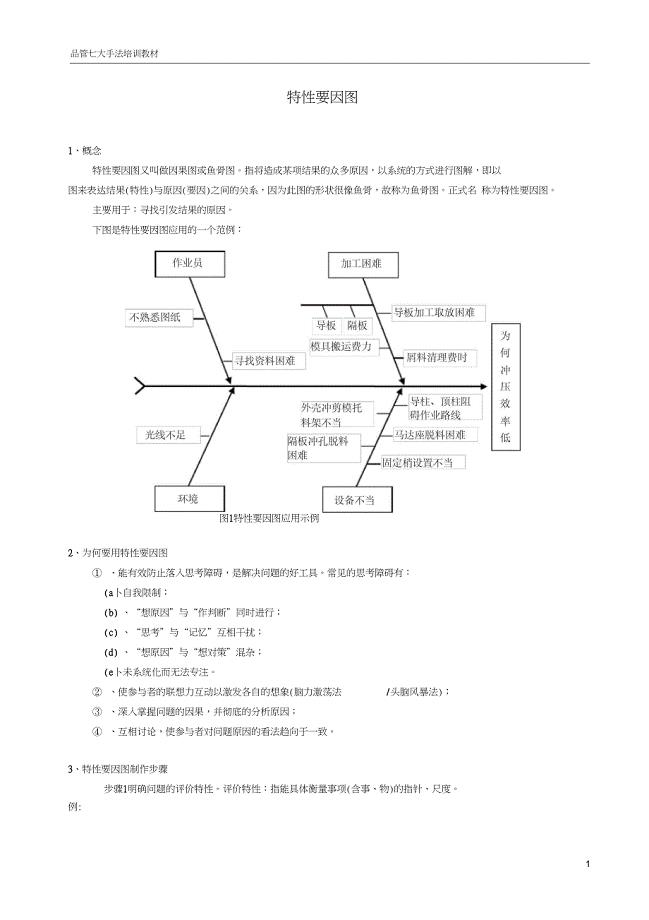
4-因果图-特性要因图(追查原因用)

2023年吉林省安全工程师安全生产法主体及其行为范围试题

2023年广东省广州市花都区新雅街道合和社区工作人员考试模拟题含答案

2014-2015第一学期Unit23单元测试卷

暑假社会实践的活动总结模板(3篇).doc

房地产专项整治工作汇报

班主任家长会发言稿
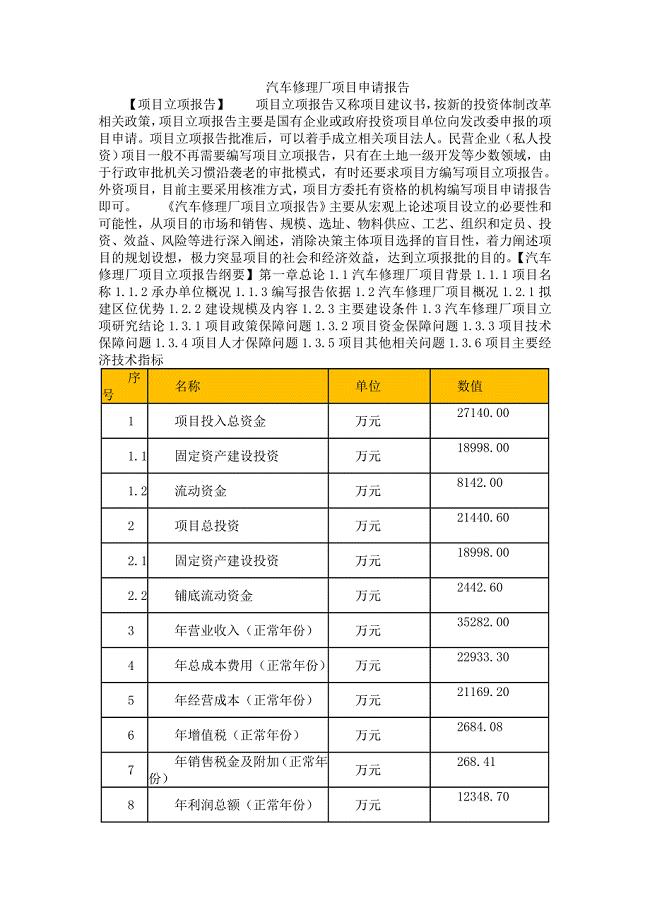
汽车修理厂项目申请报告
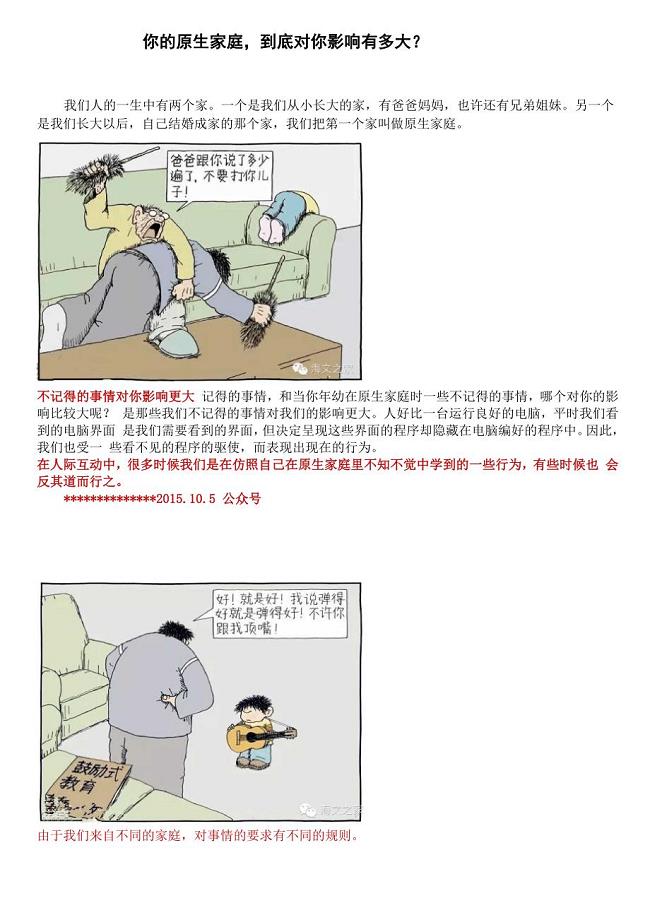
原生态家庭到底影响有多大

2023幼儿园教师实习报告模板10篇

信息经济时代企业知识型员工的管理

老字号品牌使用合作协议范本专业版

2023年诚信演讲稿范文汇总八篇

(实用模板)2023学习教育心得体会模板集锦八篇

庆祝教师节学生代表发言稿教师节学生代表演讲稿

如何护理老人
![[产品渠道经理有关市场和销售的工作总结] 渠道经理月度工作总结](https://union.152files.goldhoe.com/2022-7/15/1a2bd084-11cf-4133-b06c-5e445711ebdf/pic1.jpg)
[产品渠道经理有关市场和销售的工作总结] 渠道经理月度工作总结

龙湖财务部岗位说明书

民政局双拥工作总结
 山东临沂莒南七年级上阶段性质量检测数学
山东临沂莒南七年级上阶段性质量检测数学
2023-05-12 5页
 承包商安全管理标准
承包商安全管理标准
2023-05-27 22页
 A1人教版新课标小学一年级体育全套的教案表格式
A1人教版新课标小学一年级体育全套的教案表格式
2023-10-14 117页
 2021年公司财务年终工作总结范文与计划8篇
2021年公司财务年终工作总结范文与计划8篇
2023-05-31 37页
 临时施工便道施工设计
临时施工便道施工设计
2023-10-02 11页
 带有数字的古诗句
带有数字的古诗句
2023-10-21 2页
 绿色安全文明施工组织方案
绿色安全文明施工组织方案
2023-02-09 27页
 四川省宜宾市翠屏区八年级语文上期期末模拟试题一新人教版
四川省宜宾市翠屏区八年级语文上期期末模拟试题一新人教版
2023-03-29 6页
 动漫营销资讯0830
动漫营销资讯0830
2022-10-03 35页
 中医医院等级评审标准
中医医院等级评审标准
2023-08-24 7页

