
高考化学一轮课时达标习题 第2章 化学物质及其变化2含解析
6页1、第2章化学物质及其变化(2)1下列离子方程式书写正确的是(B)ACl2通入水中:Cl2H2O=2HClClOB双氧水加入稀硫酸和KI溶液:H2O22H2I=I22H2OC用铜作电极电解CuSO4溶液:2Cu22H2O2CuO24HDNa2S2O3溶液中加入稀硫酸:2S2O4H=SO3S2H2O2下列解释事实的方程式不正确的是(C)A用浓盐酸检验氨:NH3HCl=NH4ClB碳酸钠溶液显碱性:COH2OHCOOHC钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe3e=Fe3D长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2CO2=CaCO3H2O解析 A项,盐酸具有挥发性,挥发出的HCl与氨气反应生成氯化铵,冒白烟,正确;B项,碳酸钠是强碱弱酸盐,溶液中存在CO的水解平衡:COH2OHCOOH,使溶液呈碱性,正确;C项,钢铁发生吸氧腐蚀,铁作负极被氧化,电极反应式为Fe2e=Fe2,错误;D项,石灰水与空气中的二氧化碳反应生成碳酸钙,正确。3下列各组离子或分子能大量共存,当加入相应试剂后,发生反应的离子方程式书写正确的是(B)选项离子或分子加入试剂加入试剂后发生反应的离子方程式ANH、Fe
2、2、SO少量Ba(OH)2溶液2NHSOBa22OH=BaSO42NH3H2OBNa、OH、Cl少量Mg(HCO3)2溶液Mg22HCO4OH=2H2OMg(OH)22COCK、NH3H2O、CO通入少量CO22OHCO2=COH2ODFe2、NO、HSONaHSO4溶液HSOH=SO2H2O解析 A项中的各离子能大量共存,但加入少量Ba(OH)2溶液时,OH先与Fe2反应,故反应的离子方程式为Fe2SOBa22OH=BaSO4Fe(OH)2,A项不正确;B项中的各离子能大量共存,加入少量Mg(HCO3)2溶液后,OH与Mg2及HCO都发生了反应,B项正确;C项中的离子和分子也能大量共存,通入少量CO2时,CO2与NH3H2O反应,正确的离子方程式为2NH3H2OCO2=2NHCOH2O,C项不正确;D项中的离子不能大量共存,因为HSO使溶液呈酸性,酸性条件下,NO可将Fe2氧化,D项不正确。4下列对应化学反应的离子方程式书写正确的是(C)A用KIO3氧化酸性溶液中的KI:5IIO3H2O=3I26OHB向NH4HCO3溶液中加入过量NaOH溶液并加热:NHOHNH3H2OC将过量SO
3、2通入冷氨水中:SO2NH3H2O=HSONHDBa(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH恰好反应一半时:Ba22OH2HSO=BaSO42H2O5下列离子方程式书写正确的是(C)A等物质的量的Ba(OH)2与明矾溶液混合:3Ba26OH2Al33SO=3BaSO42Al(OH)3BFe(OH)3溶于氢碘酸:Fe(OH)33H=Fe33H2OCHO中投入Na2O2固体:2HO2O=4OH18O2DCuCl2溶液中加入NaHS溶液:Cu22HS2H2O=Cu(OH)22H2S解析 A项,因Ba2SO=BaSO4,3OHAl3=Al(OH)3,所以等物质的量的Ba(OH)2与明矾KAl(SO4)212H2O溶液混合:3Ba26OH2Al33SO=3BaSO42Al(OH)3,正确;B项,因生成的Fe3能与I发生氧化还原反应:2Fe32I=2Fe2I2,错误;C项,因氧化物在离子方程式中不能拆开,Na2O2应写化学式,且应生成O2,错误;D项,因Cu2与HS不会发生双水解,而发生反应:Cu2HS=CuSH,错误。6下列有关离子检验的叙述正确的是(C)选项操
4、作及现象结论A取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀不溶解溶液中含有Ag或SOB取少量溶液于试管中,滴加新制氯水,溶液由无色变为黄色溶液中含有BrC取少量溶液于试管中,滴加浓氢氧化钠溶液,微热,试管口湿润的红色石蕊试纸变蓝溶液中含有NHD取少量溶液于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色原溶液中含有Fe27水溶液X中只可能溶有K、Mg2、Al3、AlO、SiO、SO、CO、SO中的若干种离子(水电离出的H、OH忽略不计)。某同学对该溶液进行了如下实验:下列判断正确的是(B)A沉淀甲是硅酸和硅酸镁的混合物BK、AlO和SiO一定存在于溶液X中C气体甲一定是纯净物DCO和SO一定不存在于溶液X中解析 加盐酸有气体产生说明溶液中一定含有CO、SO中的至少一种离子,生成的气体可以是CO2或是SO2或是二者的混合物,一定不存在和CO或SO不能大量共存的离子,所以不存在Mg2、Al3,加盐酸有沉淀,说明一定有SiO,硅酸是沉淀,加入过量氨水(提供OH)有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在Al3,但是原来溶液中的Al3一定不能存在,所以该Al
《高考化学一轮课时达标习题 第2章 化学物质及其变化2含解析》由会员壹****1分享,可在线阅读,更多相关《高考化学一轮课时达标习题 第2章 化学物质及其变化2含解析》请在金锄头文库上搜索。

克和千克的认识教学设计(公开课用)

重铬酸钾安全技术说明书(共6页)

基于视觉的静态图片中人体姿态估计进行了研究

中秋节团团圆圆祝福语

银行论文银行业论文关于银行的论文:关于我国银行业压

2022年中级统计师考前密押冲刺卷136

扶贫基金申请书

第三单元我们的文化经济权利单元测试人教版八年级下11doc初中政治

OHSMS审核员考试题库

第十一周三年级语文教案-副本

北京某大厦照明设计方案范文

公司停电通知

《我的高校》重回封建俄国七篇

公司活动策划四篇

富士智能智慧型停车场管理系统解决方案
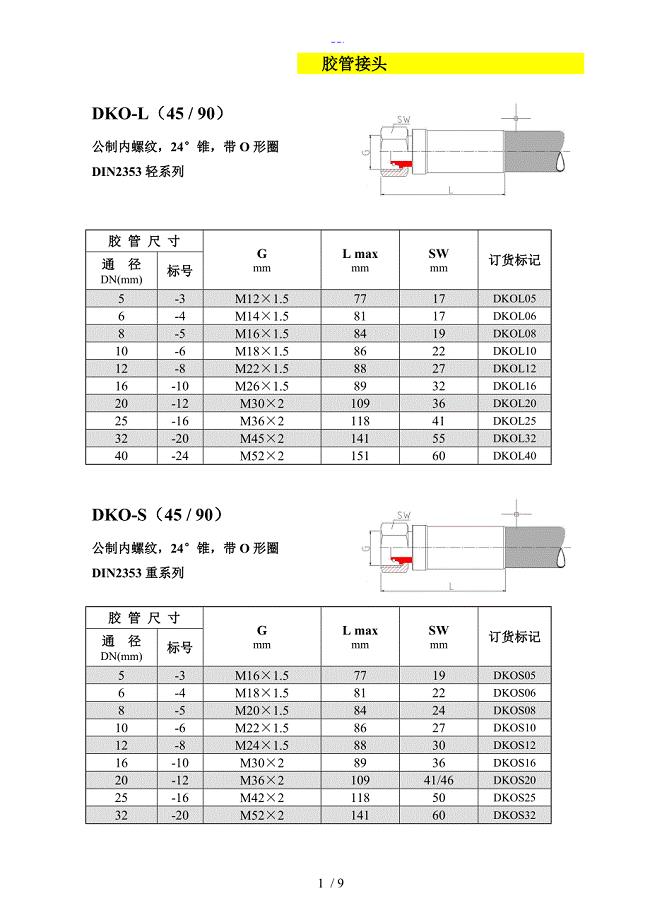
国外常见胶管接头标准

技术经济学课程设计S公司某产品生产项目分析
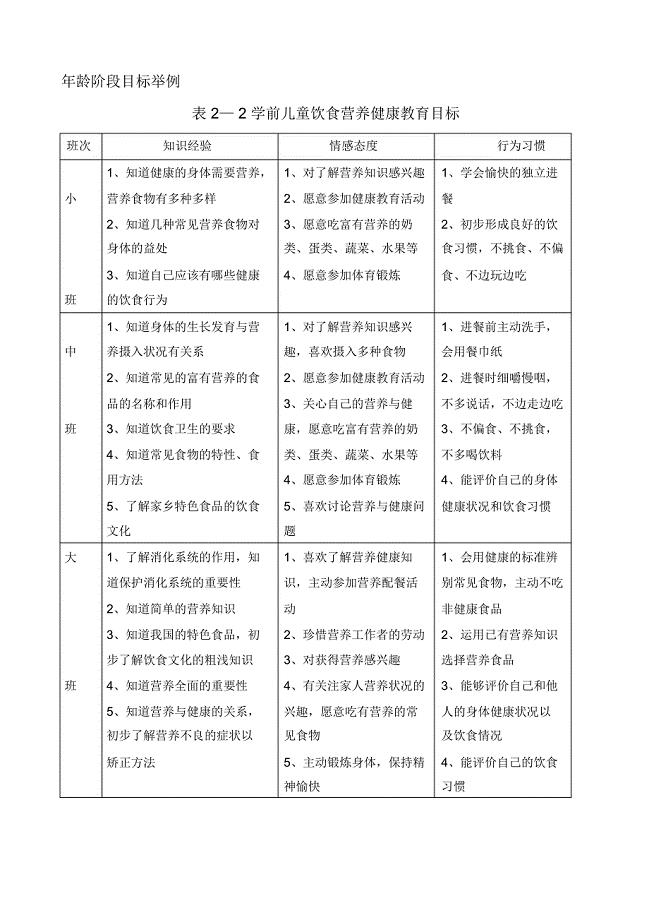
幼儿园饮食与营养教育年龄阶段目标

山东省泰安市中考语文专项练习能力提升试题及答案_5
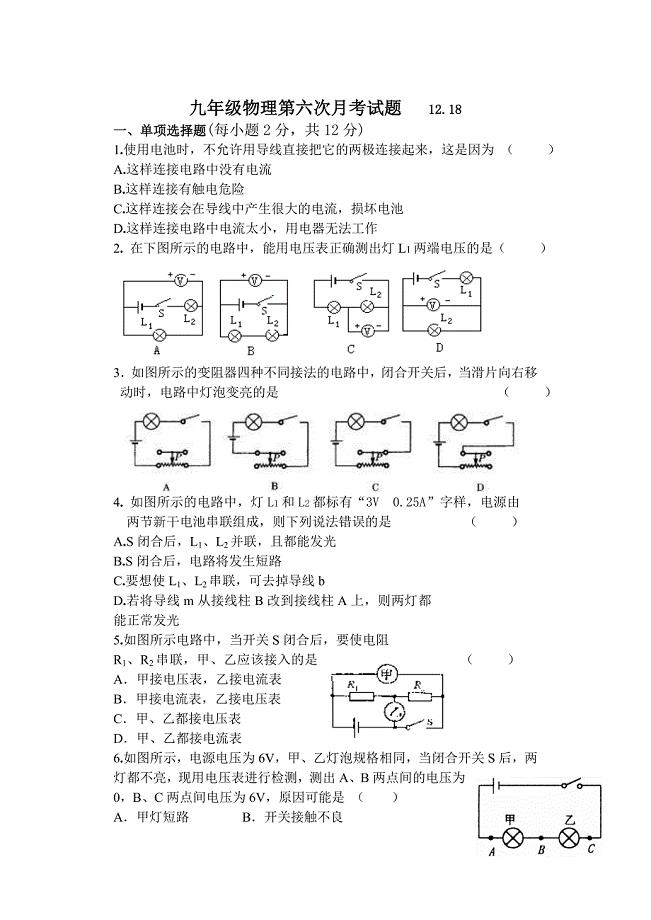
九年级物理第六次月考试题
 精选类七年级生物下册3.4.1尿的形成和排出导学案无答案新版济南版
精选类七年级生物下册3.4.1尿的形成和排出导学案无答案新版济南版
2023-10-19 2页
 内网门户平台建设解决方案
内网门户平台建设解决方案
2024-01-14 15页
 银行论文银行业论文关于银行的论文:关于我国银行业压
银行论文银行业论文关于银行的论文:关于我国银行业压
2023-07-28 12页
 第二章实数习题精选及答案
第二章实数习题精选及答案
2023-01-09 7页
 第三单元我们的文化经济权利单元测试人教版八年级下11doc初中政治
第三单元我们的文化经济权利单元测试人教版八年级下11doc初中政治
2023-10-05 10页
 昆明的雨1x群文阅读教学设计
昆明的雨1x群文阅读教学设计
2022-10-02 14页
 2022年起重机司机(限桥式起重机)资格证书考试内容及模拟题带答案点睛卷89
2022年起重机司机(限桥式起重机)资格证书考试内容及模拟题带答案点睛卷89
2022-12-15 12页
 法律法规清单新
法律法规清单新
2023-05-24 20页
 2021年安全生产工作总结汇报材料
2021年安全生产工作总结汇报材料
2022-07-30 6页
 成功的人生是需要奋斗的
成功的人生是需要奋斗的
2022-09-03 3页

