
【化学】离子晶体同步课件 2023-2024学年高二下学期化学人教版(2019)选择性必修2
28页1、高中化学选必2年年 级:高二级:高二 学学 科:化学(人教版)科:化学(人教版)3.离子晶体第三章晶体结构与性质第三节金属晶体与离子晶体1.1.借助离子晶体等模型认识晶体的结构特点。借助离子晶体等模型认识晶体的结构特点。2.2.认识离子晶体的物理性质与晶体结构的关系。认识离子晶体的物理性质与晶体结构的关系。3.3.知道介于典型晶体之间的过渡晶体及混合型晶体是普通存在的。知道介于典型晶体之间的过渡晶体及混合型晶体是普通存在的。学习目标学习目标1.1.结合常见的离子化合物和金属单质的实例结合常见的离子化合物和金属单质的实例,认识这些物质的构成微粒、认识这些物质的构成微粒、微粒间相互作用与物质性质的关系微粒间相互作用与物质性质的关系,培养宏观辨识与微观探析的核心素养。培养宏观辨识与微观探析的核心素养。2.2.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。3.3.借助离子晶体、金属晶体等模型认识晶体的结构特点借助离子晶体、金属晶体等模型认识晶体的结构特点,预测物质的性质预测物质的性质,形成证据推理与模型认知的核心素养。形成证据推
2、理与模型认知的核心素养。重晶石重晶石BaSOBaSO4 4莹石莹石 CaFCaF2 2 胆矾胆矾 CuSOCuSO4 45H5H2 2O O明矾明矾 KAl(SOKAl(SO4 4)2 212H12H2 2O O下列晶体构成微粒有什么共同点?下列晶体构成微粒有什么共同点?微粒之间存在哪种相同微粒之间存在哪种相同的作用力的作用力?【主干知识梳理【主干知识梳理】一、离子键和离子晶体1、离子键(1)(1)概念:概念:阴、阳离子之间通过静电作用静电作用形成的化学键叫做离子键离子键。含有离子键的化合物称为离子化合物离子化合物(2)(2)成键的微粒:成键的微粒:阴、阳离子阴、阳离子(3)(3)离子键离子键的本质:的本质:阴、阳离子之间的静电作用静电作用,它包括阴、阳离子之间的引力引力和两种离子的原子核之间以及它们的电子之间的斥力斥力两个方面,当引力引力与斥力斥力之间达到平衡时,就形成了稳定的离子化合物,它不显电性不显电性(4)(4)成键原因:成键原因:活泼金属原子容易失去电子而形成阳离子,活泼非金属原子容易得到电子形成阴离子。当活泼金属遇到活泼非金属时,电子发生转移,分别形成阳、阴离子,再通过静电
3、作用形成离子键(5)(5)成键条件成键条件活泼金属活泼金属(如如:K、Na、Ca、Ba等,主要是A和A族元素)和活泼非金属活泼非金属(如如:F、Cl、Br、O等,主要是A族和A族元素)相互结合时形成离子键酸根阴离子酸根阴离子与金属阳离子金属阳离子(含NH4+)之间形成离子键(6)(6)存在范存在范围:围:离子键只存在于离子化合物离子化合物中,常见的离子化合物:强碱强碱(NaOH)、活活泼金属氧化物泼金属氧化物(Na2O、Na2O2、K2O、CaO、MgO)、大多数盐类大多数盐类(NaCl、Na2SO4,但AlCl3、BeCl2例外)(7)(7)离子键的特征:离子键的特征:没有方向性没有方向性和饱和性饱和性。这是因为阴、阳离子在各个方向上都可以与带相反电荷的离子发生静电作用(没有方向性);在静电作用下能够达到的范围内,只要空间条件空间条件允许,一个离子可以同时吸引多个带相反电荷的离子(没有饱和性)。因此,以离子键结合的化合物倾向于形成紧密堆积紧密堆积,使每个离子周围尽可能多地排列异性电荷异性电荷的离子,从而达到稳定的目的2、离子晶体(1)(1)概念:概念:由阴、阳离子阴、阳离子通过离子键
4、离子键结合而成的晶体叫离子晶体(2)(2)构成的微粒:构成的微粒:阴离子阴离子和阳离子阳离子。离子晶体中含有离子,但离子不能自由移动。若获得能量而变为熔融态或溶于水中时,则离子键被削弱甚至断裂,电离产生能够自由移动的离子(3)(3)微粒间的作用力:微粒间的作用力:离子键(4)(4)气化气化或熔化时破坏的作用力:或熔化时破坏的作用力:离子键(5)(5)常见的离子晶体:常见的离子晶体:离子化合物都是离子晶体3、离子晶体的物理性质(1)(1)离子晶体常温下都为固态,具有离子晶体常温下都为固态,具有较高较高的的熔点熔点、沸点沸点。离子晶体中有较强的离子键,熔化或汽化时需消耗较多的能量。因此离子晶体有较高的熔点、沸点和难挥发性。离子晶体熔、沸点高低一般比较规律:离子晶体熔、沸点高低一般比较规律:阴、阳离子的电荷数越大,离子半阴、阳离子的电荷数越大,离子半径越小,离子键越强,离子晶体熔、沸点越高。径越小,离子键越强,离子晶体熔、沸点越高。【练习】【练习】比较下列离子晶体熔、沸点高低:NaCl CsCl,MgO MgCl2(2)(2)离子晶体硬而脆,难压离子晶体硬而脆,难压缩。缩。离子晶体中,阴、阳
5、离子间有较强的离子键,离子键表现了较大的硬度,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎(3)(3)离子晶体不导电,但离子晶体不导电,但熔化熔化或或溶于水溶于水后能导电。后能导电。离子晶体中,离子键较强,阴、阳离子不能自由移动,即晶体中无自由移动的离子,因此离子晶体不离子晶体不导电导电。当升高温度时,阴、阳离子获得足够的能量克服了离子间的相互作用力,成为自由移动的离子,在外加电场的作用下,离子定向移动而导电。离子晶体溶于水时,阴、阳离子受到水分子的作用成了自由移动的离子(或水合离子),在外加电场的作用下,阴、阳离子定向移动而导电(4)(4)溶解性:溶解性:大多数离子晶体易溶易溶于极性溶剂极性溶剂(如水)中,难溶难溶于非极性非极性溶剂(如汽油、煤油)中。当把离子晶体放入水中时,水分子对离子晶体中的离子产生吸引,使离子晶体中的离子克服离子间的相互作用力而离开晶体,变成在水中自由移动的离子(5)(5)离子晶体无延展性:离子晶体无延展性:离子晶体中阴、阳离子交替出现,层与层之间如果滑动,同性离子相邻而使斥力增大导致不稳定,所以离子晶离子晶体无延展性体无延展性.【微点拨】【微点拨】
《【化学】离子晶体同步课件 2023-2024学年高二下学期化学人教版(2019)选择性必修2》由会员s****6分享,可在线阅读,更多相关《【化学】离子晶体同步课件 2023-2024学年高二下学期化学人教版(2019)选择性必修2》请在金锄头文库上搜索。

【化学】原子结构 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】元素周期律课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】元素周期表课件 2023-2024学年高一下鲁科版(2019)必修第二册

【化学】有机物分子中共面问题课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3

【化学】烯烃炔烃的性质课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3

【化学】微项目 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】微项目 补铁剂中铁元素的检验——利用配合物进行物质检验课件 高二下鲁科版(2019)选择性必修2
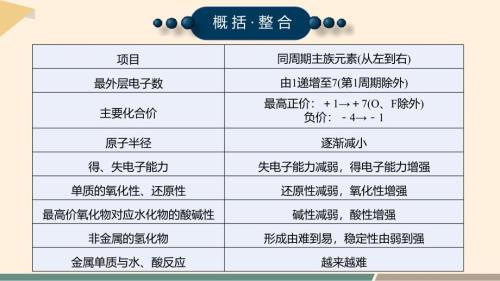
【化学】同主族元素的相似性和递变性课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】认识同周期元素性质的递变规律件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】醛和酮 糖类和核酸课件 2023-2024学年高二化学人教版(2019)选择性必修2
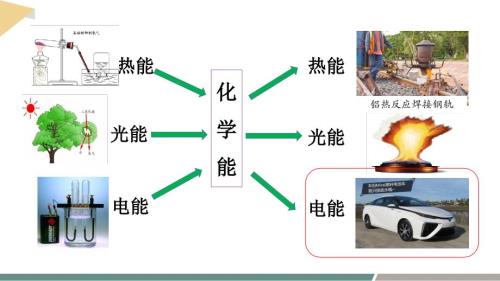
【化学】能量转化的应用——化学电池课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学键与物质构成课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学反应与能量转化 化学能与热能课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学反应的限度课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学反应的快慢课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】分子间作用力课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修2

【化学】电极方程式书写课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【地理】服务业区位因素及其变化 教学设计2023-2024学年高中地理人教版(2019)必修二

【化学】盐化肥检测题-2023-2024学年九年级化学人教版下册

【化学】金属和金属材料测试题----2023-2024学年九年级化学人教版下册
 【课件】2024届高考政治二轮复习要点及策略 课件
【课件】2024届高考政治二轮复习要点及策略 课件
2024-05-22 149页
 【课件】2024届高三化学二轮复习 有机化学命题特点与复习策略报告课件
【课件】2024届高三化学二轮复习 有机化学命题特点与复习策略报告课件
2024-05-22 62页
 2024届高三英语一轮复习名词性从句课件
2024届高三英语一轮复习名词性从句课件
2024-05-22 61页
 定语从句课件-2024届高三英语二轮复习
定语从句课件-2024届高三英语二轮复习
2024-05-22 54页
 2024届高考现代文阅读Ⅰ考情分析及备考策略+课件
2024届高考现代文阅读Ⅰ考情分析及备考策略+课件
2024-05-22 55页
 2024年中考语文总复习:古诗文默写课件
2024年中考语文总复习:古诗文默写课件
2024-05-22 108页
 第5讲+古代希腊民主政治+课件--2024届高三人民版历史必修1一轮复习
第5讲+古代希腊民主政治+课件--2024届高三人民版历史必修1一轮复习
2024-05-22 57页
 第8讲美国联邦制的建立+课件--2024届高三人民版历史必修1一轮复习
第8讲美国联邦制的建立+课件--2024届高三人民版历史必修1一轮复习
2024-05-22 60页
 2024届高考地理一轮复习课件自然地理环境差异性高考真题
2024届高考地理一轮复习课件自然地理环境差异性高考真题
2024-05-22 55页
 +非谓语动词(三)课件-2024届高考英语一轮复习
+非谓语动词(三)课件-2024届高考英语一轮复习
2024-05-22 55页

