
工科无机化学下期末复习资料完美
29页1、工科无机化学下期末复习资料完美第十章 氢、碱金属和碱土金属 一、1、氢气的制备: 实验室:Zn+2HCl=ZnCl2+H2 军事上:CaH2 +2H2O Ca2 + 2H2 2、氢化物 氢化物共分为离子型、共价型、过渡型 离子型氢化物是极强的还原剂:TiCl44NaH Ti4NaCl2H2 LiH能在乙醚中同B3 Al3 Ga3 等的无水氯化物结合成复合氢化物,如氢 化铝锂的生成。 4LiH + AlCl3 乙醚 LiAlH4 + 3LiCl 氢化铝锂遇水发生猛烈反应LiAlH44H2O=LiOHAl(OH)34H2 二、 碱金属与碱土金属元素溶于液氨,生成溶剂合电子和阳离子成具有导电性的深蓝色溶液。 碱金属 M(S) + (x+y)NH3 M+(NH3)x + e-(NH3)y 碱土金属 M(S) + (x+2y)NH3 M2+(NH3)x + 2e-(NH3) 2KNO310K=6K20N2 碱土金属氧化物也可以由他们的碳酸盐或硝酸盐加热分解得到。 CaCO3 高温CaOCO2 2Sr(NO3)2 2SrO4NO2O2 过氧化物与超氧化物 过氧化物是含有过氧基的化合物,可看作是H2
2、O2的衍生物。除铍外,所有碱金属和碱土金属都能形成离子型过氧化物。 2NaO2300 500 Na2O2 除锂、铍、镁外,碱金属和碱土金属都能形成超氧化物。 KO2=KO2 臭氧化物 在低温下通过O3与粉末状无水碱金属氢氧化物反应,并用液氨提取,即可得到红色的MO3固体: 3MOH(S)2O3(g)=2MO3(s)MOHH2O(s)1/2O2(g) 三、氢氧化物 碱金属和碱土金属的氧化物与水作用,即可得到相应的氢氧化物,并伴随着释放出大量的热: M2OH2O=2MOH MO+H2O=M(OH)2 碱金属和碱土金属的氢氧化物的碱性 碱金属和碱土金属氢氧化物除Be2外均成碱性,同族元素氢氧化物碱性均随金属金属元素原子序数的增加而增强。 氢氧化物酸碱性递变规律可用ROH规则表示。 RO+H+ ROHR+OH 离子势=阳离子电荷/阳离子半径 的值越大,按酸式电离;反正,按碱式电离。 碱金属和碱土金属溶解性 碱土金属氢氧化物的溶解度比碱金属氢氧化物小得多,并且同族元素的氢氧化物的溶解度从上往下逐渐增大。 四、盐类 晶体类型:离子晶体,具有较高的熔沸点。 颜色:碱金属离子和碱土金属离子都是无色的。
3、 热稳定性:碱金属盐具有较高的热稳定性,唯有硝酸盐热稳定性较差。 650 O C 4LiNO3 2Li2O4NO2O2 2NaNO3830 2NaNO2O2 2KNO3630 2KNO2O2 第十一章 过渡元素 1、钛族 钛的重要化合物 TiO2H2SO4(浓) TiO22NaOH(浓) TiOSO4H2O Na2TiO3H2O TiO2可溶于氢氟酸: TiO26HF TiF62-2H2H2O TiCl4水解:TiCl4 + 3H2O H2TiO3 + 4HCl Ti3易在空气中被氧化:4Ti3O22H2O 4TiO24H 2、铬族元素 (1)各族元素概述 Cr2易被空气中氧气氧化: Cr2H 4Cr24H Cr2H2 O2 铬还可与热的浓硫酸作用: 4Cr32H2O 2Cr6H2SO4(热,浓) Cr2(SO4)33SO2铬的重要化合物 6H2O 1、铬化合物 Cr2O3是难溶的两性化合物。 Cr2O33H2SO4 Cr2(SO4)33H2O Cr2O32NaOH 2NaCrO2与酸性熔矿剂共熔: H2O Cr2O3+ 3K2S2O7+ 6H+ 2Mn2+ +5O2+ 8H2O 2、
《工科无机化学下期末复习资料完美》由会员re****.1分享,可在线阅读,更多相关《工科无机化学下期末复习资料完美》请在金锄头文库上搜索。

农村二手房购房合同样本(4篇).doc

昆东互通立交工程路基排水工程开工报告

路政管理求职信

启明润泽幼儿园亲子远足活动方案(定稿)
![江苏省劳动合同范本[1]](https://union.152files.goldhoe.com/2023-3/23/98b429a3-7569-4c0f-aa85-b7ab06732878/pic1.jpg)
江苏省劳动合同范本[1]

中学生上网的利与弊
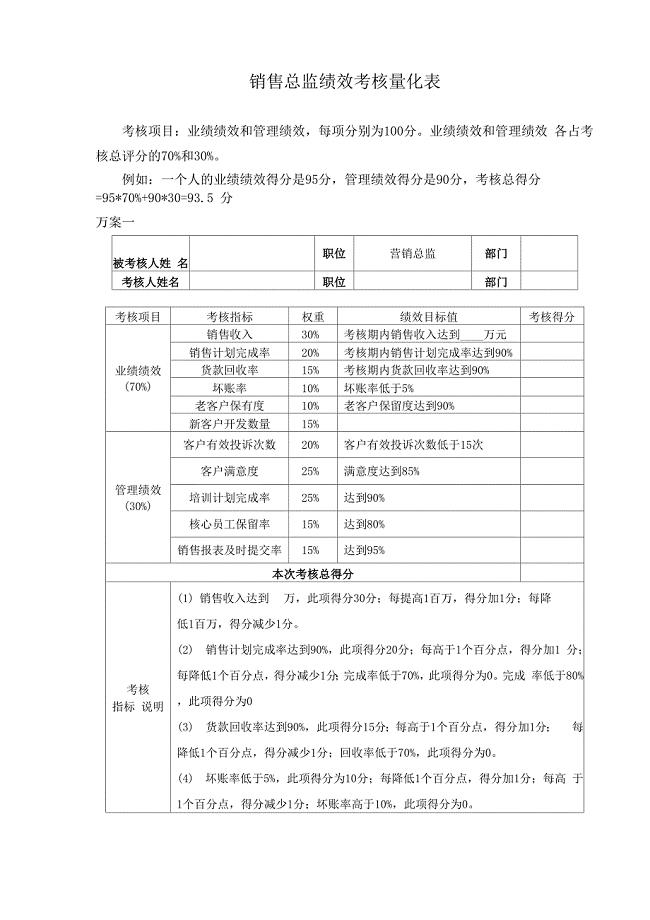
绩效考核量化表

救护车规范化管理制度(四篇).doc

中班语言优秀教案及教学反思《见面》

公司处级干部述职报告

塑力缆项目资金申请报告写作模板代写

最新 【人教版】高中语文中国文化经典研读:第九单元浙东学术检测卷及答案

西塞山前白鹭飞全诗

光的折射与透镜练习题

教师外出参观心得体会15篇.doc
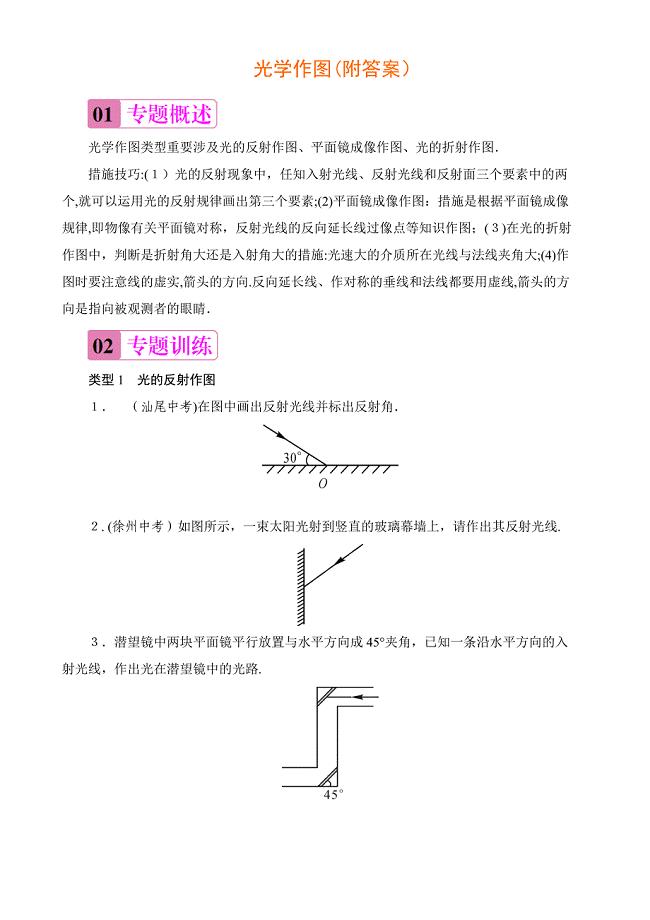
八年级物理光学作图专项训练及答案

程序员的实习报告四篇

九月九日忆山东兄弟背景解析

2022家庭贫困申请书范文大全

经营权转让合同集合6篇
 最新高中数学北师大版选修22模块综合测试2 Word版含解析
最新高中数学北师大版选修22模块综合测试2 Word版含解析
2023-07-26 10页
![[安徽]河道水系整治施工组织设计(投标-河道治理)(DOC 82页)](/Images/s.gif) [安徽]河道水系整治施工组织设计(投标-河道治理)(DOC 82页)
[安徽]河道水系整治施工组织设计(投标-河道治理)(DOC 82页)
2022-11-08 82页
 庆国庆高考数学函数专题练习
庆国庆高考数学函数专题练习
2023-07-22 2页
 三国演义之蜀国主要人物介绍
三国演义之蜀国主要人物介绍
2022-10-22 8页
 滑轮优秀教案
滑轮优秀教案
2023-01-30 8页
 三亚关于成立钻具公司可行性研究报告
三亚关于成立钻具公司可行性研究报告
2022-09-23 118页
 公司资本形成制度1
公司资本形成制度1
2023-02-05 5页
 砖砌体砌筑分项工程质量技术交底卡
砖砌体砌筑分项工程质量技术交底卡
2022-10-01 3页
 施工现场重大危险源识别及控制标准板
施工现场重大危险源识别及控制标准板
2023-06-17 18页
 智能化系统工程施工合同书
智能化系统工程施工合同书
2022-11-01 28页

