
第19讲难溶电解质的溶解平衡
6页1、专题第7讲 难溶电解质的溶解平衡课程标准 1了解难溶电解质的溶解平衡2知道沉淀转化的本质考纲要求 (1)了解难溶电解质在水中的溶解情况。(2)理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念。(3)掌握运用浓度商和平衡常数来分析沉淀的溶解、生成和沉淀的转化。(4)掌握简单的利用KSP的表达式,计算溶液中相关离子的浓度。自主学习1知识网络 一、难溶电解质的溶解平衡1概念:在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)2难溶电解质在水中的沉淀溶解平衡和化学平衡、电离平衡一样,合乎平衡的基本特征、满足平衡的变化基本规律,其基本特征为:(1) 可逆过程 (2) 沉积和溶解速率相等 (3) 各离子浓度不变 (4) 改变温度、浓度等条件平衡移动 3溶度积KSP反映了难溶电解质在水中的 溶解能力 ,KSP的大小和溶质的溶解度不同,它只与温度 有关,与 浓度无关。利用溶度积KSP可以判断 沉淀的生成、溶解情况以及 沉淀溶解平衡移动方向 。4沉淀的转化是 一种难溶电解质转化为另一种难溶电解质 的过程,其
2、实质是沉淀溶解平衡的移动。当Qc 大于 Ksp时,情况为:此时有沉淀析出 直至沉积与溶解达到平衡 当Qc 等于 Ksp时,情况为:沉积与溶解处于平衡状态 若溶液中存在难溶电解质,当Qc 小于 Ksp时,情况为:则难溶电解质会溶解,直至沉积与溶解达到平衡状态 。二、沉淀溶解平衡的应用1沉淀的生成(1)方法:A、调节PH法 B、加沉淀剂法 C、同离子效应法 D、氧化还原法如:工业原料氯化铵中混有氯化铁,加氨水调pH值至78Fe3 + 3NH3H2O=Fe(OH)3+3NH4 如:沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂Cu2+S2= CuS Hg2+S2= HgS(2)原则:生成沉淀的反应能发生,且进行得越完全越好(3)意义:物质的检验、提纯及工厂废水的处理等2沉淀的溶解 原理:设法不断移去溶解平衡体系中的相应离子,使平衡向 沉淀溶解 的方向移动。 举例 难溶于水的盐溶于酸中,如:CaCO3、FeS、Al(OH)3、Cu(OH)2溶于盐酸。 难溶于水的电解质溶于某些盐溶液,如:Mg(OH) 2溶于NH4Cl溶液(1) 酸碱溶解法(2) 盐溶解法(3) 生成配合物使沉淀溶解(4)
3、 发生氧化还原反应使沉淀溶解 3沉淀的转化 (1) 方法:加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子。使平衡向溶解的方向移动。(2) 实质:生成溶解度更小的难溶物【小结】改变条件使难溶电解质的溶解平衡移动使沉淀生成,或沉淀溶解,或沉淀转化。2考点精析1了解溶解平衡的建立及其特征。2掌握沉淀溶解平衡常数及其应用。3应用化学平衡移动原理分析影响溶解平衡的因素。4应用难溶电解质的溶解平衡的理论解释沉淀的生成,溶解及其转化。5考查沉淀转化的本质及综合分析的思维能力。3自主训练 1为除去MgCl2酸性溶液中的Fe3,可在加热搅拌的条件下,加入一种试剂,过滤后再加入适量盐酸,这试剂不可以是 ( )ANH3H2O BMgO CMg(OH)2 DMgCO32将100mL 0.1mol/L的AgNO3溶液加入足量的NaCl和NaF的混合溶液中,产生1.435g沉淀,则下列说法正确的是(AgF溶解度:182g/100g) ( )A产生的沉淀为AgCl B产生的沉淀为AgFC产生的沉淀为AgF和AgCl DAgF溶于水3石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH (
《第19讲难溶电解质的溶解平衡》由会员m****分享,可在线阅读,更多相关《第19讲难溶电解质的溶解平衡》请在金锄头文库上搜索。
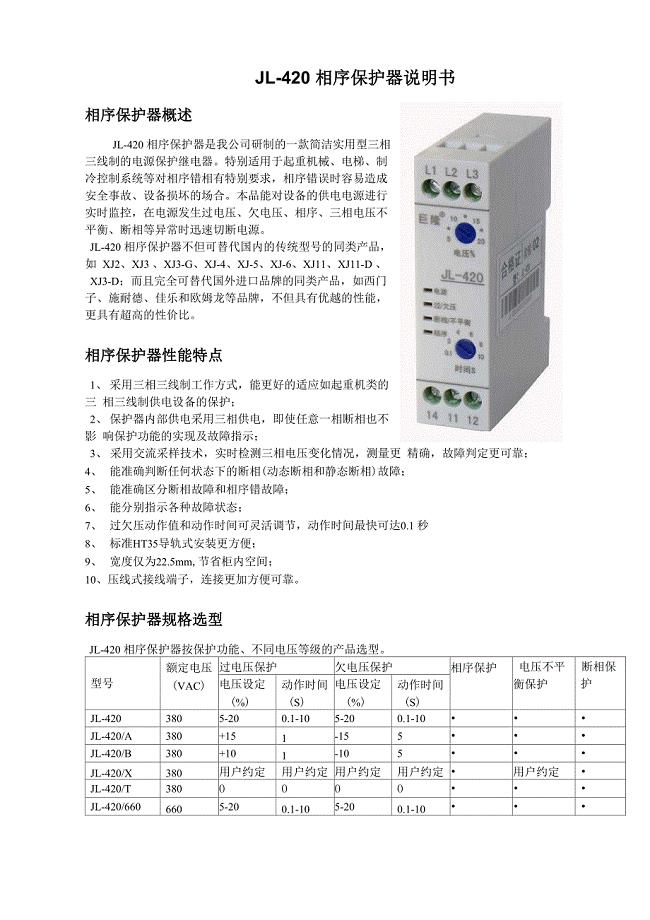
相序保护器

生产部工作总结模板.doc

贵州会计从业资格考试题:会计电算化(全真第一套)

《医疗广告审查申请表》(含医疗广告成品样件表)

有关面试老师自我介绍模板汇总六篇

建筑规程公司门卫制度

Java基础常见英语词汇(共70个)

春雨小学作文集锦15篇

防灾减灾项目可研报告

2021年又是一个新的开始学生作文

装潢合作协议书

技术部2022年上半年工作总结范文

如何规避签订无固定期限劳动合同

家长孩子的表扬信
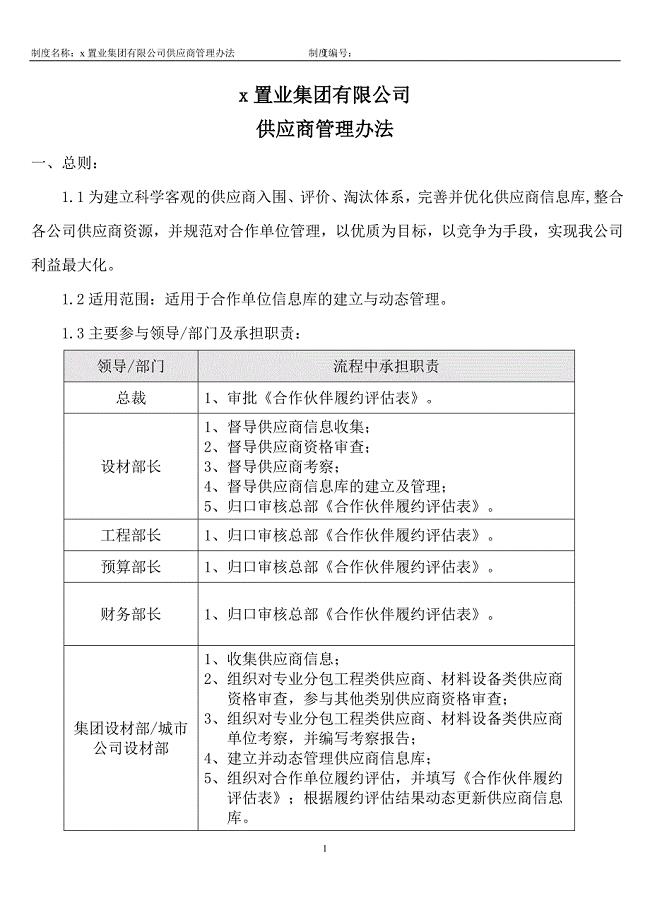
置业集团有限公司供应商管理办法

福建师范大学21秋《中国教育简史》在线作业一答案参考23

财政法规制度考点分析报告

亚运专题团日活动总结-活力在基层

肥皂盒注塑模具毕业设计设计说明书

中国成立70周年感悟心得祖国七十周年感受体会作文5篇
 幼儿园教师保育工作计划(2篇).doc
幼儿园教师保育工作计划(2篇).doc
2023-10-06 3页
 2022无子女离婚协议书范文
2022无子女离婚协议书范文
2023-08-24 6页
 物业管理基础知识试题(100题)
物业管理基础知识试题(100题)
2023-08-05 10页
 工程技术员工作总结
工程技术员工作总结
2022-07-24 4页
 学校春季运动会加油稿15字
学校春季运动会加油稿15字
2023-02-02 6页
 最新高考数学文一轮分层演练:第9章平面解析几何 第4讲 Word版含解析
最新高考数学文一轮分层演练:第9章平面解析几何 第4讲 Word版含解析
2023-04-01 6页
 浅析LED的现状和发展前景
浅析LED的现状和发展前景
2023-06-05 13页
 XX企业客户关系管理解决方案.doc
XX企业客户关系管理解决方案.doc
2023-04-28 4页
 读《把事情做到最好》心得体会
读《把事情做到最好》心得体会
2023-09-24 2页
 2021年部编人教版一年级语文下册期末试卷附答案
2021年部编人教版一年级语文下册期末试卷附答案
2024-02-15 4页

