
专题:水溶液中的离子平衡
4页1、专题:水溶液中的离子平衡1、电解质、非电解质,强、弱电解质的概念及其判断。电解质:酸、碱 、盐,H2O非电解质:大多数有机物、SO3、CO2等1)单质、混合物既不是电解质也不是非电解质。2)CO2、NH3等不是电解质3)难溶的盐(CaCO3、BaSO4等)是电解质。强电 解质:实例:强酸(盐酸、硝酸、硫酸、氢溴酸、氢碘酸、高氯酸)、强碱(钾、钠、钡、钙)、多数盐、部分碱性氧化物弱电解质:实例:弱酸、弱碱和水。例:有下列物质:石墨 SO3(s) Na2O HCl(l) Cl2 熔融的K2SO4 H2SO4(aq)乙醇 冰醋酸 氨水 。其中能导电的是 1.6.7.10;属于强电解质的是 3.4.6属于弱电解质的有 9 ;属于非电解质的有 2.8 。2、电解质的电离方程式,盐类水解方程式。电离方程式书写:强电解质在溶液中完全电离,用“”弱电解质在溶液中部分电离,用“ ”多元弱酸的电离 应分步完成电离方程式,多元弱碱则一步完成电离方程式。如: CH3COOH、H2S、Cu(OH)2、H2SO4、KHCO3、KHSO4、NH3H2O盐类水解的化学、离子方程式的书写:无弱不水解;有弱才水解谁弱谁水
2、解;谁强显谁性盐类水解是可逆反应,要写 符号,不写“”符号。盐类水解的程度一般很小,水解产物很少,通常不生成沉淀和气体,不用“”、“”符号,也不把生成物(如H2CO3、NH3H2O等)写成分解产物的形式。多元弱酸盐分步水解,以第一步水解为主,水解方程式一般只写第一步;多元弱碱盐的水解不分步书写。 如:Na2CO3、(NH4)2SO4、AlCl3、CH3COONH4 例.下列离子方程式中,属于水解反应的是:A.HCOOH+H2OHCOO+H3O+B.CO2+H2OHCO+H+C.CO+H2OHCO+OHD.HS+H2OS2+H3O+3、影响电离平衡、水解平衡、溶解平衡的因素.符合勒夏特列原理 电离平衡、水解平衡、溶解平衡 CH3COOH CH3COO-+H+平衡移动C(CH3COO-)C(H+)温度升温向右增大增大浓度加水向右减小减小同离子效应加盐酸向左减小增大加醋酸钠向左增大减小化学反应加氢氧化钠向右增大减小填表:CH3COONa溶液中存在以下水解平衡:CH3COONa+H2O CH3COOH+NaOH,改变下列条件,填写变化情况:改变条件平衡移动 C(CH3COO-) C(OH-)C
《专题:水溶液中的离子平衡》由会员cl****1分享,可在线阅读,更多相关《专题:水溶液中的离子平衡》请在金锄头文库上搜索。

常压储罐定期检验及结果评价汇总 (2)

贵州某水电站人工砂石系统工程项目安全事故应急预案

保健用品生产规范
![项目状态报告表[项目管理表格]](https://union.152files.goldhoe.com/2023-6/23/4ca55dee-bc0d-475c-80f8-8b87615484a8/pic1.jpg)
项目状态报告表[项目管理表格]

小学三年级班主任工作计划(二)

2023年吉林省延边州和龙市八家子镇河南村社区工作人员考试模拟题含答案

2021-2021学年绿色学校创建方案

榆林煤炭资源开发管理实施意见

推荐-2013年三类人员网上学习试题(单选、多选、判断)

公司“青年优才方法”培养方法

2022中秋节活动策划_1

28831《家用电器维修技术》教材习题答案

2022有关小学写景作文合集八篇

大二学年总结样本(2篇).doc
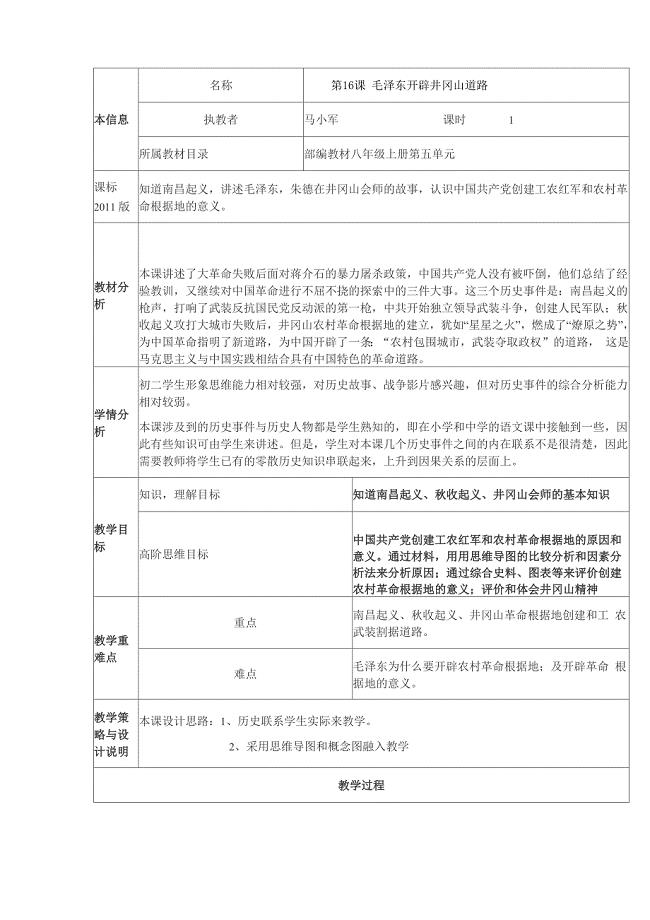
第16课 毛泽东开辟井冈山革命道路教案新0001

成都市总工会

六年级下册心理健康教育教学计划

药品集中采购与医疗改革

高考化学专题1化学基本概念Word版

南开大学21秋《工程项目管理》在线作业二答案参考26
 2014学年第一学期八年级数学拓展课练习三
2014学年第一学期八年级数学拓展课练习三
2023-10-14 2页
 体育馆工程施工设计方案及对策
体育馆工程施工设计方案及对策
2023-03-04 14页
 组工干部三严三实学习心得体会
组工干部三严三实学习心得体会
2023-01-16 2页
 经济常识知识点整理
经济常识知识点整理
2023-09-12 22页
 小学数学 (4)
小学数学 (4)
2024-02-03 4页
 房产销售代表(旅游劳动合同(双休)
房产销售代表(旅游劳动合同(双休)
2023-10-16 2页
 2022小学体育教学计划_90
2022小学体育教学计划_90
2024-01-01 52页
 28831《家用电器维修技术》教材习题答案
28831《家用电器维修技术》教材习题答案
2023-05-15 14页
 家乡的特产文字报告
家乡的特产文字报告
2022-08-21 5页
 安全文明施工准则
安全文明施工准则
2022-09-28 18页

