
2020届高考化学工艺流程试题复习讲义
29页1、2020届高三考前冲刺工艺流程题专项训练1.2019年诺贝尔化学奖授予约翰古迪纳夫、斯坦利威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:已知:Ksp ( Li2CO3)=1.610-3 。部分物质的溶解度(S)如下表所示:TS(Li2CO3)/gS(Li2SO4)/gS(Li3PO4)/g201.3334.20.039800.8530.51000.72(1)从“正极”可以回收的金属有_。(2)写出碱溶时Al箔溶解的离子方程式_。(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为_。(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4_mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为_。(5)流程中用“热水洗涤”的原因是_。(6)若滤液中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉
2、降率到90%,计算滤液中c(CO32-)=_mol/L。(7)“沉淀”时_(填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是_。2.石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(3.4%)、Fe2O3(3.1%)、和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:(注:SiCl4的沸点为57.6,金属氯化物的沸点均高于150) (1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_。(2)高温反应后,石墨中氧化物杂质均转变为相应氯化物,气体1中的碳氧化物主要为_,由气体II中某物质得到水玻璃的化学反应方程式为_;(3)步骤为:搅拌、_,所得溶液IV中的阴离子有_;(4)由溶液IV生成沉淀V的总反应的离子方程式_,10t(吨)初级石墨最多可获得沉淀V的质量为_kg;(5)以石墨为原料可人工制造金刚石。若2.4g石墨完全转为金刚石时吸热0.38kJ,则该反应的热化学方程式为_;(6)石墨可用于自然水体中铜件的电化学防腐,则图中电键K应与_(选填“A”、“B”)相连,可实现铜件的防腐。3.PdCl2广泛用作催化剂和一些物质的检测
3、试剂。由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为_。(2)对工艺流程图中的滤液处理办法最好的是:_a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为_。(4)赶硝,是将残余的NO3浓度降低到不大于0.04%。实验数据记录如表:表一:不同HCl用量和MxOy用量(每10gPd)与NO3残留量HCl用量(mL)MxOy用量(mL)NO3含量(%)50、10、20、30、400.15、0.10、0.05、0.04、0.03100、5、10、15、200.10、0.08、0.05、0.03、0.02150、5、10、15、200.08、0.06、0.05、0.03、0.02处理1吨Pd,需要用到HCl和MxOy的总体积至少为_m3(合理选择表格里相关数据计算)。(5)煅烧过程发生分解反应,化学方程式为:_。(6)浸有
《2020届高考化学工艺流程试题复习讲义》由会员无**分享,可在线阅读,更多相关《2020届高考化学工艺流程试题复习讲义》请在金锄头文库上搜索。
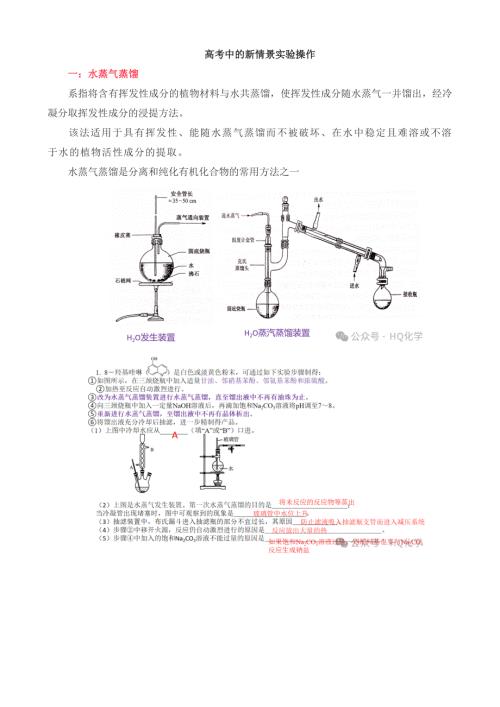
2024年高考化学实验新情景实验操作复习

2023-2024江西省高三年级二轮复习阶段性检测化学试卷

广东省深圳市2024届高三第一次模拟考试化学试题及答案

基于核心素养的数学高考模拟试题命题研究和实践

备考策略11:2024年高考政治主观题命题特点和备考策略(课件)-2024年高考政治新教材命题特点和备考策略(二轮复习专用)

2024年新高考物理内容特点分析及复习备考策略

2024年 新高考物理内容特点分析及复习备考策略

2024届高考思想政治复习备考策略讲座

2024届高考二轮复习有机化学命题特点与复习策略报告

2024年高考数学复习备考策略讲座

基于核心素养的2024年高考数学模拟试题命题研究和复习策略

析试题、明方向提能力课件-2024届高考政治二轮复习备考

2024年高考数学一轮复习策略

新课程评价与新高考探究专题课件-2024届高三数学一轮复习

2024年河北省新高考政治二轮复习策略探讨课件-2024届高考政治二轮复习统编版

2024届高三二轮复习策略研讨“物理模型建构与拓展应用”课件:《静电场》

2024.1海淀期末考试高一化学试卷

高二化学上期期末考试试卷 (1)

2024.1丰台高二上期末化学试题

2024.1丰台高三上期末化学试题
 2024年【初中政治】初中三年道法知识看这13张表就够了(强烈推荐)
2024年【初中政治】初中三年道法知识看这13张表就够了(强烈推荐)
2024-04-26 11页
 2024年【初中语文】初中作文审题立意100例超有用的写作技巧点拨
2024年【初中语文】初中作文审题立意100例超有用的写作技巧点拨
2024-04-26 23页
 2024年【初中语文】文言文180个实词+17个重点虚词超全整理
2024年【初中语文】文言文180个实词+17个重点虚词超全整理
2024-04-26 27页
 2024年100个作文常用文言文点睛金句考前抓紧摘抄
2024年100个作文常用文言文点睛金句考前抓紧摘抄
2024-04-26 23页
 2024年【初中语文】34道初中诗词鉴赏题汇总一定要掌握初中3年都有用
2024年【初中语文】34道初中诗词鉴赏题汇总一定要掌握初中3年都有用
2024-04-26 37页
 2024年【初中语文】七八九年级上下册课内成语及解释汇总收藏学习
2024年【初中语文】七八九年级上下册课内成语及解释汇总收藏学习
2024-04-26 20页
 2024年【初中政治】答题公式+万能答题模板太有用了收藏能用三年
2024年【初中政治】答题公式+万能答题模板太有用了收藏能用三年
2024-04-26 18页
 2024年119消防知识竞赛题库及答案(共70题)
2024年119消防知识竞赛题库及答案(共70题)
2024-04-26 10页
 2024年【初中语文】中考满分作文10篇(精读细研)总有一篇让你受益匪浅
2024年【初中语文】中考满分作文10篇(精读细研)总有一篇让你受益匪浅
2024-04-26 34页
 2024年108段中考满分作文精彩语段汇总
2024年108段中考满分作文精彩语段汇总
2024-04-26 24页

