
化学反应速率的影响因素讲义Word版
10页1、第二章 化学反应速率与化学平衡第二节 影响化学反应速率的因素知识点一、有效碰撞理论1有效碰撞 2活化分子与活化能活化分子能够发生有效碰撞的分子活化分子能量高,碰撞时,破坏分子内部原子之间的“结合力”,重新组合成生成物分子活化能活化分子比普通分子高出的能量活化能越小,普通分子就越容易变成活化分子即普通分子活化能活化分子只表示一般分子成为活化分子的难易程度,但对这个化学反应前后的能量变化并不产生任何影响,即对反应热数值没影响E1指反应的活化能,E2-E1是反应热。3化学反应速率与活化分子、有效碰撞的关系 活化分子的百分数越大,单位体积内_越多,单位时间内_越多,化学反应速率_。活化分子数 有效碰撞的次数 越快知识点二、影响化学反应速率的因素1、 主要影响因素:内因物质本身的性质2、 次要影响因素:外因(1)浓度影响规律:其他条件不变时增大 减小微观解释:其他条件不变时,增大反应物浓度单位体积内活化分子数增多有效碰撞几率增加化学反应速率增大。 反之,减小反应物浓度,化学反应速率减小。注意事项: 对化学反应速率的影响因素是指物质的量浓度,而不是指物质的量或反应物的总量。 对于纯液体或固体物质,
2、可认为其浓度为“常数”,它们的量的改变不会影响化学反应速率。 但固体物质的反应速率与接触面积有关,颗粒越细,表面积越大,反应速率越大。例1、把下列四种X溶液分别加入四个盛有10 mL 2 mol/L 盐酸的烧杯中,均加水稀释到50 mL.此时,X和盐酸缓慢地进行反应,其中反应最快的是 ()A10 20 mL 3 mol/L的X溶液B20 30 mL 2 mol/L的X溶液C10 10 mL 4 mol/L的X溶液D10 10 mL 2 mol/L的X溶液解析分析本题,在其他条件不变的情况下,比较速率大小,先比较浓度的大小此时,浓度必须是混合后的浓度,由于混合后各烧杯中盐酸浓度相等,所以只要求出X的浓度是最大者反应最快,然后比较温度的高低A项中,c(X) mol/L1.2 mol/L;B项中,c(X) mol/L1.2 mol/L;C项中,c(X) mol/L0.8 mol/L;D项中,c(X) mol/L0.4 mol/L.由此可见,混合后A、B选项中X的浓度最大,但是二者温度不同A项中为10,B项中为20,故选项B中反应速率最大答案 B例2、已知反应CaCO32HCl=CaCl2H2
3、OCO2,下列措施中可使生成CO2的速率加快的是(不考虑CaCO3与HCl接触面积改变的影响) ()A加大CaCO3的量B加大盐酸的浓度C加大盐酸的量 D减小CaCl2的浓度解析:加大反应物的量不影响化学反应速率,改变浓度才影响化学反应速率,由于给定的反应是不可逆反应,因此,此化学反应的速率和生成物的浓度无关答案: B(2) 压强:针对气体影响规律:在相同温度下, 压强改变常见几种情况:恒温不恒容时:增大压强体积缩小物质浓度增大反应速率增大。恒温恒容时:充入反应气体该物质浓度增大该反应速率迅速增大。充入“无关气体”(如He、Ne、Ar等不参与本反应也不干扰本反应的气体) 总压强增大,但反应混合物的各组分浓度没有改变反应速率不变。恒温恒压时:充入“无关气体” 体积增大反应混合物各组分的浓度减小反应速率减小。例2 反应C(s)H2O(g)CO(g)H2(g)在一可变容积的密闭容器中进行,下列条件的改变使其反应速率增大的是 () A增加C(s)的量 B将容器的体积缩小一半 C保持体积不变,充入N2使体系压强增大 D保持压强不变,充入N2使容器体积变大 解析A项,C为固体,增加其用量,不影响反
4、应速率;B项,加压能使反应速率增大;C项,保持体积不变,充入N2后各反应物的浓度不变,不影响反应速率;D项,保持压强不变充入N2,容器体积增大,反应物浓度减小,使反应速率减小。 答案B(3)温度影响规律:其他条件相同时增大 减小微观解释: 其他条件相同时,升高温度活化分子百分数提高和较高能量的分子间的碰撞频率提高有效碰撞几率提高化学反应速率增大。注意事项: 温度对反应速率的影响规律,对于吸热反应、放热反应都适用,且不受反应物状态的限制。 升高温度,正、逆反应速率均增大,但增大的程度不同;降低温度,正、逆反应速率均降低,但降低的程度也不同。(4)催化剂影响规律:使用合适的催化剂,可_化学反应速率。加快微观解释:使用合适的催化剂降低反应所需的_增加_增加化学反应速率_。活化能 活化分子百分数 有效碰撞次数 加快E1为反应的活化能,使用催化剂时的活化能为E3,反应热为E1E2注意事项: 催化剂有正、负之分,正催化剂能加快反应速率,负催化剂减慢反应速率,不特别指明的条件下,均指正催化剂。 催化剂只有在一定温度下,才能最大限度的发挥其催化作用。5从活化分子角度解释外界条件对反应速率的影响活化能单
《化学反应速率的影响因素讲义Word版》由会员M****1分享,可在线阅读,更多相关《化学反应速率的影响因素讲义Word版》请在金锄头文库上搜索。

精品解析:云南省昆明市2020年中考英语试题(原卷版)

KTV包房系统word版

精品学校教学工作总结九篇

标准化工程现场管理制度

护士面试技巧

行业保密协议范文(10篇).doc

小学英语五年级教学计划(4篇).doc

曲折缝缝纫机说明书

玉环市废旧纺织品循环利用项目计划书

门禁管理系统设计

初中周记的作文汇编10篇
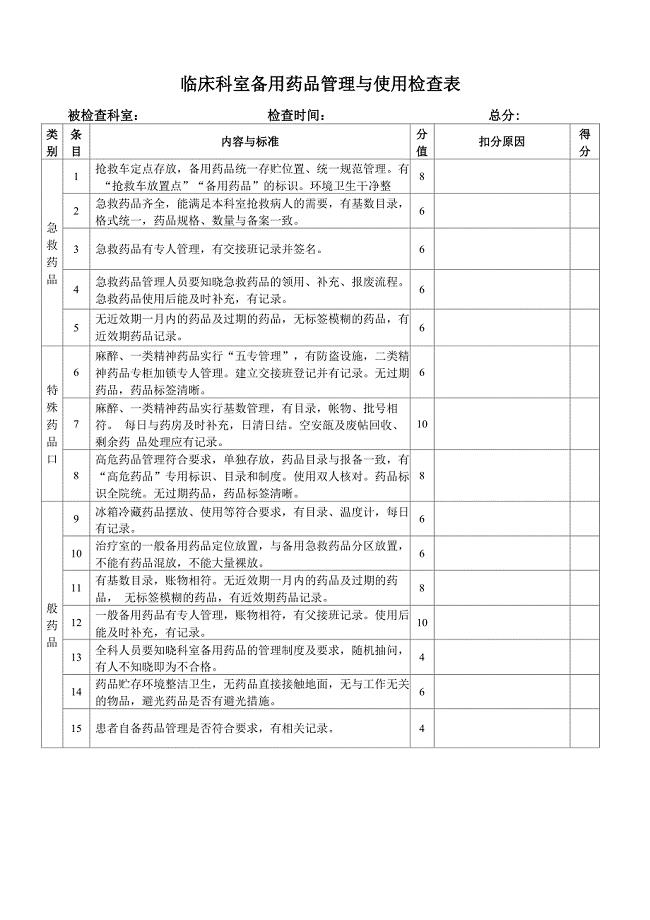
临床科室备用药品管理与使用检查表

卫生院基本公共卫生服务工作进展报告

2023年实用语文周记范本锦集8篇

(新版)煤炭生产经营单位(煤矿井下安管员)考试题库及答案

破碎岗位安全生产工作职责和管理制度

中原工学院信息商务学院

胶砂试模检定规程

汽车饰件生产项目商业计划书写作模板招商融资

到村任职一年座谈会发言稿
 2023年同等学力申硕医学综合真题及参考答案
2023年同等学力申硕医学综合真题及参考答案
2023-09-11 46页
 预防医学全复习
预防医学全复习
2022-12-07 30页
 2023年安全评价师试题基础知识B
2023年安全评价师试题基础知识B
2023-09-16 21页
 中原工学院信息商务学院
中原工学院信息商务学院
2023-08-12 9页
 常用电子产品检验记录表格
常用电子产品检验记录表格
2024-01-13 2页
 成语大全(四字成语大全)
成语大全(四字成语大全)
2024-03-01 32页
 设备备件类物资库存管理及控制
设备备件类物资库存管理及控制
2023-02-12 10页
 2023年助理物流师考试真题及答案
2023年助理物流师考试真题及答案
2023-01-02 15页
 南开大学21秋《环境学基础》在线作业二答案参考100
南开大学21秋《环境学基础》在线作业二答案参考100
2023-02-01 13页
 大连理工大学21春《领导科学》离线作业一辅导答案48
大连理工大学21春《领导科学》离线作业一辅导答案48
2023-02-15 11页

