
(通用版)2021高考化学二轮复习逐题对点特训3
22页1、(通用版)2017高考化学二轮复习逐题对点特训3逐题对点特训31(2016宁夏银川九中质检)用NA表示阿伏加德罗常数的值。下列说法正确的是(B)A常温常压下,2.24 L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NAB30 g乙酸和甲醛的混合物中氧原子数为NAC25 时,2 L 0.1 molL1的 Na2CO3溶液中含有的CO总数为0.2NAD某密闭容器中盛有0.2 mol SO2和0.1 mol O2,在一定条件下充分反应,生成SO3分子数为0.2NA2(2016江苏省扬州中学模拟)设NA为阿伏加德罗常数的值。下列说法中正确的是(D)A标准状况下,11.2 L NO和11.2 L SO3的分子总数为NAB0.1 mol Br2与足量H2O或NaOH反应转移的电子数均为0.1NAC0.1 mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NAD在精炼铜或电镀铜的过程中,当阴极析出铜32 g转移电子数均为NA解析:A项,标准状况下,SO3为固体;B项,Br2与H2O反应是可逆反应;C项,0.1 mol P4中含有0.6 mol共价键。3(2016江苏溧阳戴埠
2、高中三模)NA代表阿伏加德罗常数的数值。下列说法正确的是(D)A1 mol Cl2参加的任何反应,反应过程中转移电子数都是2NAB标准状况下,11.2 L乙醇所含的羟基数为0.5NAC常温常压下,17 g甲基(14CH3 )所含的中子数为9NAD室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为36.021023个解析:A项,1 mol Cl2与H2O反应,转移电子数小于NA,与NaOH反应,转移电子数等于NA;B项,标准状况下,乙醇为液体;C项,17 g14CH3所含中子数为8NA。4在水中加入等物质的量的Ag、Pb2、Na、SO、NO、Cl,该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为(C)A35.5108B16207C81D10835.5解析:等物质的量的这几种离子放入水中后Ag与Cl、Pb2与SO恰好完全反应生成AgCl和PbSO4沉淀,因此实际上相当于用惰性电极电解NaNO3溶液,根据离子放电顺序实质上是电解水,则氧化产物为氧气,还原产物为氢气,容易得出质量比为81,C项正确。5(2016全国卷乙)设NA为阿伏加德罗常数值。下列
3、有关叙述正确的是(A)A14 g乙烯和丙烯混合气体中的氢原子数为2NAB1 mol N2与4 mol H2反应生成的NH3分子数为2NAC1 mol Fe溶于过量硝酸,电子转移数为2NAD标准状况下,2.24 L CCl4含有的共价键数为0.4NA解析:A项乙烯和丙烯的分子式分别为C2H4、C3H6,二者的最简式均为CH2,14 g乙烯和丙烯混合气体中含有“CH2”的物质的量为1 mol,故所含氢原子数为2NA。B项N2和H2合成氨的反应为N23H22NH3,该反应为可逆反应,1 mol N2与4 mol H2反应生成的NH3小于2 mol,故生成的NH3分子数小于2NA。C项Fe与过量的硝酸反应生成Fe(NO3)3,故1 mol Fe参加反应时转移电子数为3NA。D项标准状况下,CCl4为液体,2.24 L CCl4的物质的量远大于0.1 mol,故含有的共价键数远大于0.4NA。6设NA为阿伏加德罗常数的数值。下列说法正确的是(B)A常压下,22.4 L氧气与金属钠完全反应,转移的电子数一定是4NAB常温常压下,1.7 g H2O2中含有电子数为0.9NAC1 L 0.2 molL
4、1FeCl3溶液中,含有Fe3粒子数为0.2NAD标准状况下,0.1 mol甲苯所含CC键数为0.6NA解析:A项,温度不确定。常压下22.4 L氧气不一定是1 mol,生成物也不确定是Na2O还是Na2O2;B项1.7 g H2O2有0.05 mol 因此电子数为0.0518NA0.9 NA;C项Fe3会水解;D项,甲苯苯环结构不含CC键。7下列说法正确的是(C)A0.15 mol HF溶于水配成1 L溶液,溶液中F浓度为0.15 molL1B已知:共价键CCCCCHHH键能/kJmol1348610413436则可以计算出反应:(g)3H2(g)(g)的H为384 kJmol1C常温下,pH7的CH3COONa溶液中,c(CH3COO)c(Na)D常温下,1 L 0.10 molL1 NH4Cl溶液加1 L水即可稀释为0.05 molL1的NH4Cl溶液解析:A项,氢氟酸为弱酸,所得溶液中c(F)0.15 molL1;B项,甲苯中苯环上的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键,根据提供的共价键及键能不能计算出该反应的反应热;C项,pH7的CH3COONa溶液中,根据电荷守恒可
《(通用版)2021高考化学二轮复习逐题对点特训3》由会员新**分享,可在线阅读,更多相关《(通用版)2021高考化学二轮复习逐题对点特训3》请在金锄头文库上搜索。

四年级数学下册 第4单元 小数的意义和性质 4.2 小数的读、写法备选练习 新人教版

让语文教科书与课外阅读有机地链接

广州XX瓶装饮用水市场营销策划案
![[管理]环境保护处工作职责](https://union.152files.goldhoe.com/2023-9/1/4ab15821-4275-4049-ad65-2c4da803bbbf/pic1.jpg)
[管理]环境保护处工作职责

领导年会总结发言稿参考样本(二篇).doc

2022年湖北武汉东湖学院辅导员招考聘用模拟试卷【含答案解析】_3

精品广东省茂名市高三第一次高考模拟考试

关于沟通的实验报告例文

2021年信息技术组期末工作总结

电气装置安装工程施工与验收标准

小学数学教研组计划标准范文(2篇).doc
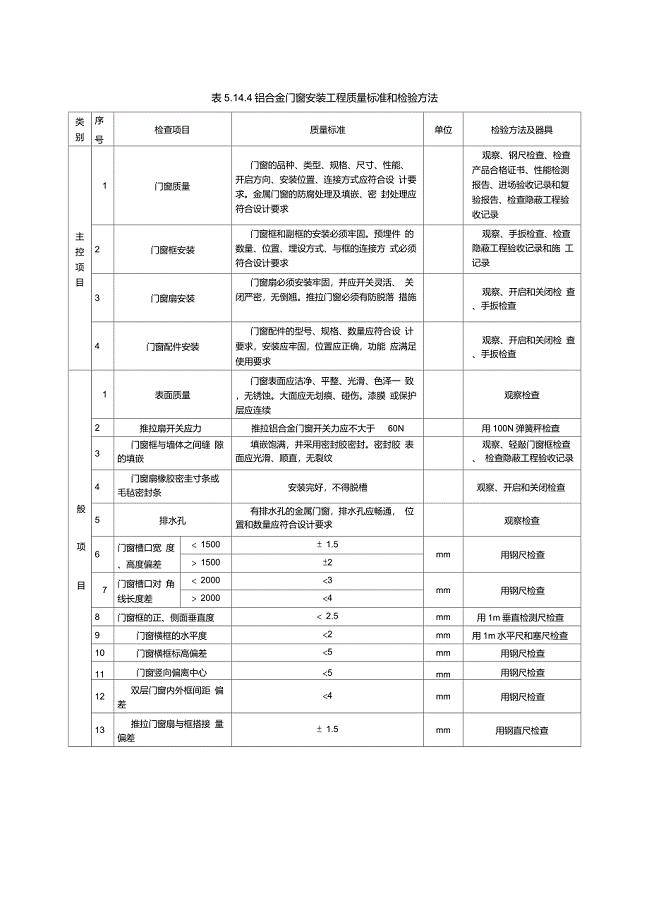
铝合金门窗安装工程质量标准和检验方法

春节里的一件事作文3篇写春节中的一件事情作文

【最新版】鲁科版选修四每课一练:2.1 化学反应的方向【含答案】

安监部各级工作职责

污水处理系统储罐拆除及更换方案

试用期员工转正申请书

景洪市高原电力装备项目投资分析报告(参考范文)

初中物理-形象化讲授
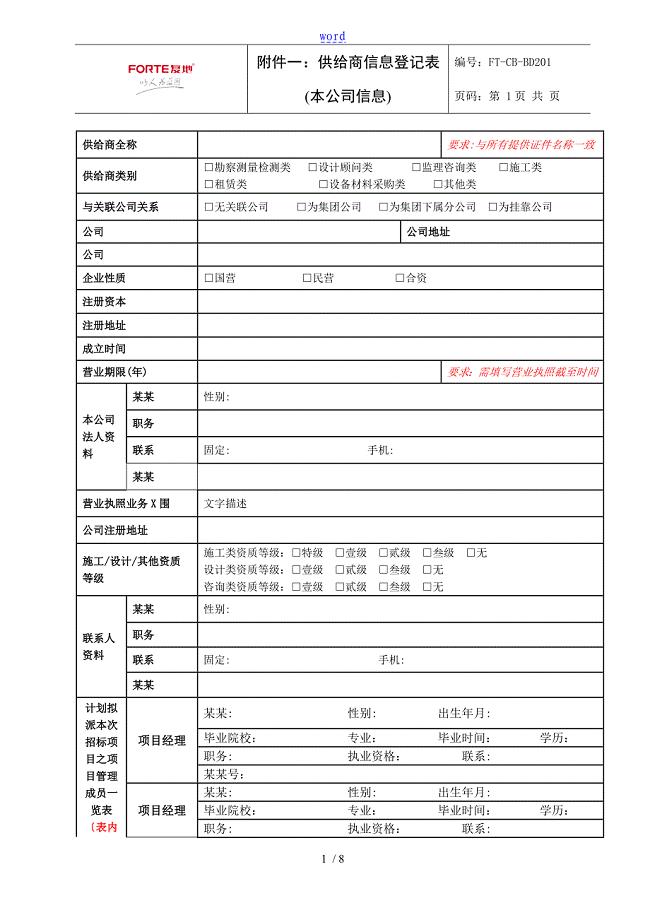
供应商登记表1
 《长方体和立方体的特征》教学设计
《长方体和立方体的特征》教学设计
2022-10-07 6页
 国产冲锋衣滑雪服品牌
国产冲锋衣滑雪服品牌
2023-02-01 25页
 浅谈管理论语读后感的解释
浅谈管理论语读后感的解释
2022-10-09 3页
 年会优秀员工演讲稿15篇
年会优秀员工演讲稿15篇
2023-06-24 37页
 学会感恩演讲稿模板合集九篇
学会感恩演讲稿模板合集九篇
2023-05-27 21页
 剑桥国际英语期中测试卷 U1-8 Test
剑桥国际英语期中测试卷 U1-8 Test
2022-11-03 12页
 一般将来时练习题
一般将来时练习题
2023-07-05 4页
 飞扬的青春演讲稿
飞扬的青春演讲稿
2023-12-16 35页
 小学英语《Read and Write》教案
小学英语《Read and Write》教案
2022-08-24 5页
 机械加工技术基础首页和教案
机械加工技术基础首页和教案
2023-07-27 49页

