
物质的量及实验0108
4页1、化学计量在实验中的应用1.物质的量(1)物质的量是国际单位制中7个基本物理量之一,它是一个物理量的名称,用符号n表示。(2)摩尔是物质的量的单位,作为计量原子、分子或离子等微观粒子的物质的量的单位,简称摩,符号为mol。物质含有阿伏加德罗常数个微粒,其物质的量就是1 mol。(3)“物质的量”是专用名词,是7个基本物理量之一,在口头或书面表达中4个字不可增减,要从整体上理解、把握其含义,不能把“物质的量”理解成物质的质量或体积。(4)“物质的量”一词不能用“摩尔数”代替。因前后两者虽然在数值上相同,但意义完全不同。前者是有单位的量,在国际单位制中,其基本单位是摩尔;而后者只是一个数,无单位。(5)物质的量及其单位摩尔,只适用于表示微观粒子(分子、原子、离子、电子、中子、质子等微粒及这些微粒的某些特定组合)。如1 mol NaCl中含有1 mol Na和1 mol Cl等,而不适合于表示宏观概念,如1 mol大米、2 mol氧元素等。2阿伏加德罗常数(NA)(1)1 mol 任何粒子的粒子数叫阿伏加德罗常数。这一单位是以0.012 kg12C所含碳原子数为基本计量标准来计量的。阿伏加德罗
2、常数的符号为NA,单位是mol1。它的实验值随测定方法的不同而不完全相同,通常使用6.021023 mol1这个近似值。(2)6.021023 mol1是阿伏加德罗常数较为精确的近似值,与阿伏加德罗常数之间不能划等号,就像3.14与的关系。运用这一知识只能说含有阿伏加德罗常数个粒子的物质的量为1 mol。如果某粒子集体含有6.021023个该粒子,我们通常认为其物质的量就是1 mol。(3)使用阿伏加德罗常数时应注意的问题:一定质量的物质中所含原子数、电子数,其中考查较多H2O、N2、O2、H2、NH3等。一定体积的物质中所含原子数、分子数,如Cl2、NH3、CH4、O2、N2、CCl4、C8H10等。一定量的物质在化学反应中的电子转移数目,曾考过的有Na、Mg、Cu等。一定体积和一定物质的量浓度溶液中所含电解质离子数、分子数,如稀硫酸、硝酸镁等。某些典型物质中化学键数目,如SiO2、Si、CH4、P4、CO2等。细微知识点(易出错):状态问题,水、CCl4、C8H10等在标准状况下为液体或固体;(4)摩尔质量(M) 单位:gmol1即g/mol,摩尔质量在数值上 = 物质的式量3.气
3、体摩尔体积(1)在相同条件下,决定物质的体积的微观因素有: 粒子的数目、粒子的(直径)大小、粒子之间的平均距离(2)气体的体积:气体粒子之间距离很大,,粒子本身的大小对物质的体积影响很小,几乎可以忽略。气体体积主要由粒子间距和粒子数决定。影响气体粒子间距的因素有:温度、压强。(3)在相同的温度和压强下,任何气体粒子之间的距离可以看成是相等的,所以粒子数相同的任何气体都具有相同的体积。即阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。(4)气体摩尔体积 单位物质的量的气体所占的体积,符号Vm,单位L/mol 和m3/mol标准状况是指0(273K)、101 kPa,标准状况下1 mol任何气体所占的体积都约是22.4 L。理解此概念必须注意四个要点:必须是气体物质,不适用于固体、液体;物质的量为1 mol;必须是标准状况;体积约是22.4 L。规律总结:气体摩尔体积的大小,与气体所处的温度和压强有关,故在应用22.4 L/mol时一定要注意是不是在标准状况(即1个大气压,0)下。气体摩尔体积(Vm)不仅适用于纯净的气体,还适用于混合气体。阿伏加德罗定律的推论
4、(可通过pVnRT导出) 特别提醒(1)应用阿伏加德罗定律时要明确三点:阿伏加德罗定律适合任何气体(包括混合气体),对固体、液体不适合。同温、同压、同体积、同分子数(同物质的量),即四同。四同相互制约,只要三同成立,则第四同也成立。气体摩尔体积是阿伏加德罗定律的一个特例。(2)确定气体的分子组成一般思路是:根据阿伏加德罗定律,由体积比推导出粒子个数比,再根据质量守恒定律确定化学式。如2体积气体Ax与1体积气体By恰好完全反应生成2体积A2B,由阿伏加德罗定律可知:气体的分子数之比等于其体积比,即AxByA2B2:1:2,所以两气体反应物为双原子分子,即A2和B2。物质的量浓度1.定义:用来表示_溶液里所含溶质B的 _的物理量。2.符号及单位:符号为_;常用单位为_ 或_。3.使用物质的量浓度的注意事项1物质的量浓度概念中的体积是溶液的体积(一般以升为单位),而不是溶剂的体积。2溶质的量是用物质的量表示,而不是用质量表示。3从一定的物质的量浓度的溶液中取出任意体积的溶液,物质的量浓度不变。4用结晶水合物配制溶液时,其溶质不应包含结晶水。例如,25 g胆矾(CuSO45H2O)溶于水后形成
《物质的量及实验0108》由会员pu****.1分享,可在线阅读,更多相关《物质的量及实验0108》请在金锄头文库上搜索。

中考数学一轮复习第五章图形的变换与尺规作图第2节平移和旋转试题

项目委托合同范本(九篇).doc

高中数学必修1教学教案(二分法求方程的近似解)

纪录片《穹顶之下》观后感8篇

关注三角形的外角教案孙晓银

处理行业市场分析及投资机遇研究报告

什么是耦合耦合电容

等差数列说课稿

ky农业工程初步设计文件材料的基本要求

2012年襄阳市初中毕业生学业考试语文试卷

传统节日除夕

描写小白兔的优秀作文

伊索寓言牧童和狼(第一课时)

幼儿园资产管理制度-幼儿园资产物品管理制度

人教版 小学9年级 数学上册 21.2 解一元二次方程第02课时—公式法精讲精练含答案

高一数学上期末试卷
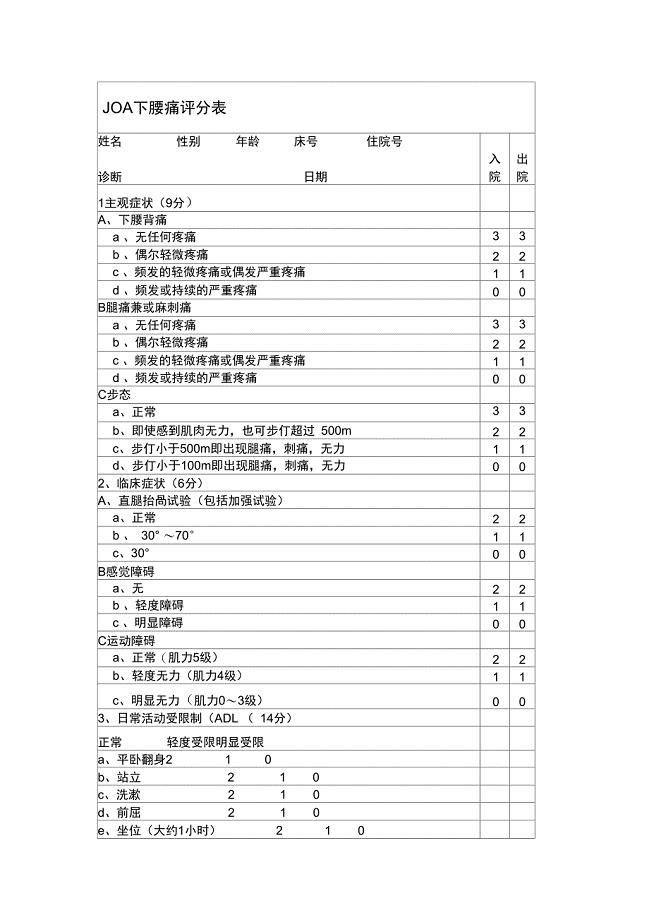
JOA下腰痛评分表

设备租赁合同参考范本(四篇).doc

(精选模板)2023年学生的自我介绍15篇
![[房地产]海景中心全程策划报告(doc51页)](https://union.152files.goldhoe.com/2023-3/30/c6b6a406-6e46-4ca5-8389-2304787651ac/pic1.jpg)
[房地产]海景中心全程策划报告(doc51页)
 柯夏线型塘岭隧道口边坡崩塌治理工程监理规程
柯夏线型塘岭隧道口边坡崩塌治理工程监理规程
2023-10-27 42页
 深静脉血栓风险评估及预防#动静脉
深静脉血栓风险评估及预防#动静脉
2023-08-28 4页
 4.1.2圆的一般方程
4.1.2圆的一般方程
2023-11-21 2页
 精品人教版五年级下册数学全册教案教学设计
精品人教版五年级下册数学全册教案教学设计
2022-08-20 153页
 最新人教版小学四年级数学上册全册教案
最新人教版小学四年级数学上册全册教案
2022-08-26 134页
 最新人教A版理科数学高效训练:74 直线、平面平行的判定及其性质
最新人教A版理科数学高效训练:74 直线、平面平行的判定及其性质
2022-08-04 8页
 95后员工职业生涯管理研究
95后员工职业生涯管理研究
2023-08-05 7页
 八年级数学上册4.4一次函数的应用第1课时确定一次函数的表达式学案无答案版北师大版1107281.
八年级数学上册4.4一次函数的应用第1课时确定一次函数的表达式学案无答案版北师大版1107281.
2023-11-05 3页
 九年级历史上册第15课血腥的资本积累教案2新人教版
九年级历史上册第15课血腥的资本积累教案2新人教版
2023-04-17 5页
 甘肃省西和县十里乡初级中学七年级英语上册StarterUnit3Whatcolorisit导学案无答案新版人教新目标版
甘肃省西和县十里乡初级中学七年级英语上册StarterUnit3Whatcolorisit导学案无答案新版人教新目标版
2023-07-19 4页

