
吉林省吉林地区20192020学年高二化学上学期期中试题含解析
15页1、吉林省吉林地区普通高中友好学校联合体2019-2020学年高二化学上学期期中试题(含解析)相对原子质量:C 12 N 14 O 16 S 32 K 39 Cl 35.5 Cu 64 Na 23 Ag 108 第卷(选择题共 50 分)一、选择题:本大题共10题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的。1.“焓”是指( )A. 物质所具有的内能B. 反应热的变化C. 化学键所具有的能量D. 物质的一种化学性质【答案】A【解析】【详解】焓是与内能有关的物理量,是物体所具有的能量,单位是焦耳;答案选A。【点睛】焓是与内能有关的物理量,反应在一定条件下是吸热还是放热由生成物和反应物的焓值差即焓变(H)决定。在化学反应过程中所释放或吸收的能量都可用热量(或换成相应的热量)来表示,叫反应热,又称“焓变”。焓是一个状态量,焓变是一个过程量,如同瞬时速度是状态量,平均速度是过程量。在理解是容易混淆。2.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是天然气 煤 核能 石油 太阳能 生物质能 风能 氢能A. B. C.
2、D. 【答案】C【解析】【详解】天然气、煤、石油均不是新能源和可再生能源,而且使用时,对环境有污染;核能、太阳能、生物质能、风能、氢能均符合题意。答案选C。3.下列过程中H0,故A错误;B. 氯化铵加热制备氨气为分解反应,需要吸热,H0,故B错误;C. 碳与二氧化碳高温生成一氧化碳是吸热反应,H0,故C错误;D. 实验室制备氢气用活泼金属与酸反应,为放热反应,H0,故D正确;答案选D【点睛】考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。放热反应的H小于0,吸热反应的大于0。4.下列性质中,不能说明乙醇宜作燃料的是 ()A. 燃烧时发生氧化还原反应B. 充分燃烧的产物不污染环境C. 乙醇是一种可再生能源D. 燃烧时放出大量的热【答案】A【解析】A、燃烧是氧化反应,但多数有机物均能燃烧,不能作为酒精燃烧的优点,故A错误;B、乙醇充分燃烧的产物是二氧化碳和水,对环境不造成污染,故B正确;C、乙醇可以通过有机物发酵制取得到,是可再生能源
3、,故C正确;D、乙醇的热效应较高,燃烧放出大量的热,故D正确。5. 下列情况下,反应速率相同的是A. 等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应B. 等质量锌粒和锌粉分别与等量1 mol/L HCl反应C. 等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应D. 等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应【答案】C【解析】试题分析:A中氢离子的浓度不同,反应速率不同;B中锌的表面积不同,反应速率不同;C中盐酸和硝酸都是一元强酸,所以在浓度相同的条件下,和碳酸钠的反应相同,C正确;D中稀硫酸和碳酸钙反应生成的微溶性的硫酸钙,附着在碳酸钙表面,从而阻止反应的进行。D不正确,答案选C。考点:考查反应速率的有关判断点评:该题是中等难度的试题,侧重对学生能力的培养。该题设计新颖,基础性强,有利于培养学生的逻辑推理能力和灵活应变能力。该题的易错点是选项D。6.下列热化学方程式正确的是( )A. C2H5OH+3O2=2CO2+3H2O H=-1367.0kJ/molB.
4、NaOH(aq)+HCl(aq)=NaCl(aq)+ H2O(l)H =+573kJ/molC. S(s)+ O2 (g)=SO2 (g)H =-269.8kJ/molD. 2NO(g)+O2(g)=2NO2(g)H =-116.2kJ【答案】C【解析】A 项,热化学方程式中必须标明各物质的聚集状态,错误;B项,中和反应为放热反应,H0,错误;C项,符合热化学方程式的书写原则,正确;D项,H的单位为kJ/mol,错误;答案选C。点睛:书写热化学方程式的注意点:(1)热化学方程式不注明反应条件。(2)热化学方程式不标“”“”,但必须用s、l、g、aq等标出物质的聚集状态。(3)热化学方程式的化学计量数只表示物质的量,其H必须与方程式及物质的聚集状态相对应。(4)放热反应的H0,吸热反应的H0。(5)H的单位为kJ/mol。7.设C+CO2=2CO H0的反应速率为V1;N2+3H2=2NH3H0的反应速率为V2。若升温,V1和V2的变化可能是:A. 同时增大B. 同时减少C. V1增大、V2减少D. V1减少、V2增大【答案】A【解析】考点:化学反应速率的影响因素分析:升高温度,无论对于
《吉林省吉林地区20192020学年高二化学上学期期中试题含解析》由会员大米分享,可在线阅读,更多相关《吉林省吉林地区20192020学年高二化学上学期期中试题含解析》请在金锄头文库上搜索。

精选工程合同范文合集5篇

医学生实习总结样本(4篇).doc

碎料工岗位职责

技术监督工作计划说课材料

2021年盲巷管理制度.doc

初三班主任个人总结报告(2篇).doc
![[精编][水利工程项目绩效评价工作分析]水利工程项目](https://union.152files.goldhoe.com/2023-8/26/75aee65d-e027-4069-b5f3-296bca95ae4f/pic1.jpg)
[精编][水利工程项目绩效评价工作分析]水利工程项目

休闲体育服务与管理专业可行性报告

嵌入式Web服务器技术的发展

成功治疗猪口蹄疫的方法

微型风扇马达项目创业计划书写作模板
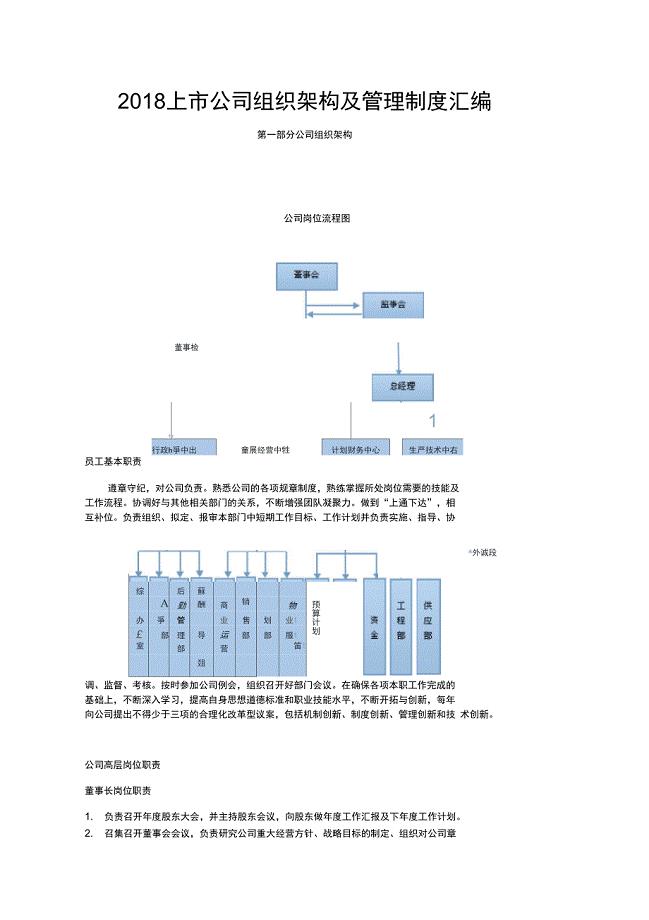
上市公司组织架构及管理制度汇编

公司法司法解释

外研版八年级英语上语法专练

桥梁护栏施工方案

工法的基本知识及其编制

广东省清远市佛冈县龙山镇八年级数学下册 2.4-2.5 一元一次不等式学案(无答案)(新版)北师大版

6_“希望工程”义演_同步练习

优秀写人作文300字集合7篇

如何提高化学作业的有效性
 广东省佛山市顺德区文田中学2013年中考数学一轮复习 整式及其运算(无答案)
广东省佛山市顺德区文田中学2013年中考数学一轮复习 整式及其运算(无答案)
2023-07-28 2页
 电大中级财务会计(一)期末复习文本
电大中级财务会计(一)期末复习文本
2022-09-18 10页
 6_“希望工程”义演_同步练习
6_“希望工程”义演_同步练习
2023-08-18 6页
 初中物理热学公式
初中物理热学公式
2023-06-24 2页
 《火烧云》教学反思
《火烧云》教学反思
2022-10-19 1页
 对于自主实习安全承诺书实用借鉴
对于自主实习安全承诺书实用借鉴
2023-10-12 7页
 2020-2021学年七年级数学下册第10章二元一次方程组检测试题无答案新版苏科版
2020-2021学年七年级数学下册第10章二元一次方程组检测试题无答案新版苏科版
2023-05-16 4页
 2019-2020学年九年级物理全册20.1能量的转化与守恒练习含解析新版沪科版
2019-2020学年九年级物理全册20.1能量的转化与守恒练习含解析新版沪科版
2022-07-30 8页
 Unit3,MyweekendplanA,Let’stalk教学设计毕玉玲
Unit3,MyweekendplanA,Let’stalk教学设计毕玉玲
2022-08-02 4页
 甘肃狮西市陇西县2017_2018学年七年级语文下学期期中试题新人教
甘肃狮西市陇西县2017_2018学年七年级语文下学期期中试题新人教
2022-08-10 14页

