
医疗器械ISO13485-2016医疗器械生产单位2020年度内审资料汇总
23页1、2020年度ISO13485:2016医疗器械生产质量管理体系内审资料汇编 ISO13485:2016医疗器械生产单位内审资料汇总2020年度ISO13485体系内审资料本内审资料汇总依据ISO13485:2016编制,含内审计划、内审时间计划安排、内审报告、不合格项目分布及14项内审单项不符合项报告maszhc2021/9/27 ISO13485:2016医疗器械生产单位内审资料汇总 编 制:maszhc审 核:XXX批 准:XXX杭州万德福医疗器械制造有限公司2020年11月25目录ISO13485:2016体系内审计划表3审核时间计划安排表4ISO13485:2016体系内部审核报告5不合格项分布表8内审不符合项报告(1)9内审不符合项报告(2)10内审不符合项报告(3)11内审不符合项报告(4)12内审不符合项报告(5)13内审不符合项报告(6)14内审不符合项报告(7)15内审不符合项报告(8)16内审不符合项报告(9)17内审不符合项报告(10)18内审不符合项报告(11)19内审不符合项报告(12)20内审不符合项报告(13)21内审不符合项报告(14)22ISO1348
2、5:2016体系内审计划表编号: WDF/QR-2020-01序号项目内容1目的检查本公司质量管理体系是否符合ISO9001:2015和ISO 13485:2016医疗器械 质量管理体系 用于法规的要求标准要求,质量体系是否有效运行。2审核依据ISO9001:2015和ISO13485:2016及YY/T0287-2017医疗器械质量管理体系用于法规的要求标准、公司质量手册及质量管理体系文件。3涉及产品心电诊断仪器、血压计、体温计、医疗纱布、绷带、医用口罩、一次性注射器等。4审核要素涉及公司全部部门、全部要素5审核时间2020年 11月 10 日6首、末次会议总经理、副总经理、管理者代表及与审核有关的部门负责人、管理人员参加。7审核组成员组长:王晓东;组员:(1)王磊、王晓东;(2)吴鹏 、蔡明8审核时间根据审核计划表执行9备注可以根据现场审核情况和公司生产情况适时进行调整编制:maszhc 审核:xxx 批准:xxx 时间: 2020年6月10日审核时间计划安排表编号: WDF/QR-2020-02日期时间内审员被审部门审核涉及的质量管理体系标准要求2020年11月10日8:309:
3、00首次会议 9:009:30XXX总经理、管理者代表4.1/4.2.1/4.2.2/5.1/5.2/5.3/5.4/5.5/5.6/6.1/8.1/8.2.2/8.4/8.510:0010:30XXX 综合部4.2.3/4.2.4/6.2/7.2/7.4.1/7.4.2/8.2.1/7.5.410:3011:30XXX仓库7.5.3.1/7.5.3.2.1/7.5.3.3/7.5.511:3013:00审核组第一次讨论审核情况13:3015:00XXX生产部6.3/6.4/7.5.1.1/7.5.1.2.1/7.5.1.2.3/7.5.2.1/7.5.3.1/7.5.3.2.1/7.5.3.315:0016:00XXX技术质量部7.1/7.4.3/7.5.3.1/7.5.3.2.1/7.5.3.3/7.6/8.2.3/8.2.4.1/8.3/8.4/8.5 16:0017:00XXX生产车间5.1/5.2/5.3/5.4/5.5/5.6/6.1/6.3/6.4/7.1/7.4.3/7.5.3.1/7.5.3.2.1/7.5.3.3/7.6/8.2.3/8.2.4.1/8.3/8.4/
4、8.517:0018:30审核组会议18:3019:30末次会议备注:1.本次体系内部审核应按照ISO9001:2015质量管理体系和YY/T0287-2017医疗器械质量管理体系用于法规的要求和体系文件等标准进行。2.本次体系审核中,每组在审核各部门时均要审核:文件控制(4.2.3)、质量方针(5.3)、质量目标(5.4.1)、记录控制(4.2.4)、培训(6.2)、纠正和预防措施(8.5)其他项目结合部门实际情况和审核时间计划安排表中涉及的要素进行审查。编制:XXX 审批: XXX 日期:2020年6月10日ISO13485:2016体系内部审核报告编号:WDF/QR-2020-03审核目的评价质量管理体系的符合性、有效性和充分性。审核范围管理层、综合部、生产部、技术质量部、生产车间、仓库等质量体系覆盖产品心电诊断仪器、血压计、体温计、医疗纱布、绷带、医用口罩、一次性注射器等审核准则医疗器械生产质量管理规范附录无菌医疗器械指导原则;GB/T19001-2016;YY/T0287-2016;公司质量手册和相关文件;适用于公司的法律、法规和其他要求审核日期2020年11月10日审核组长
《医疗器械ISO13485-2016医疗器械生产单位2020年度内审资料汇总》由会员m****c分享,可在线阅读,更多相关《医疗器械ISO13485-2016医疗器械生产单位2020年度内审资料汇总》请在金锄头文库上搜索。
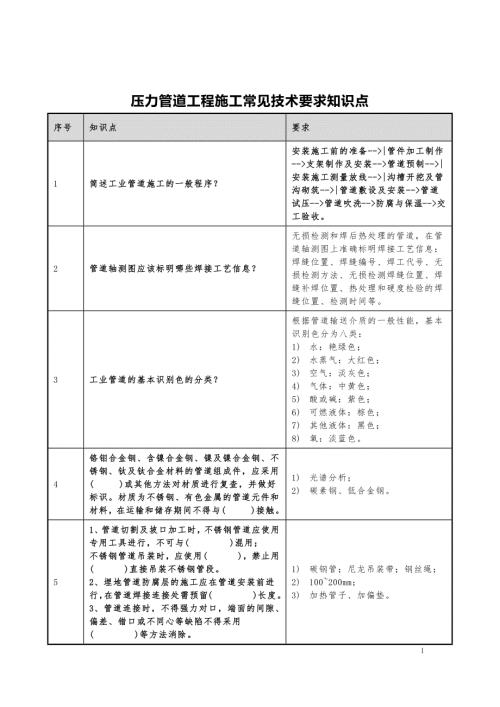
压力管道工程施工常见技术要求知识点
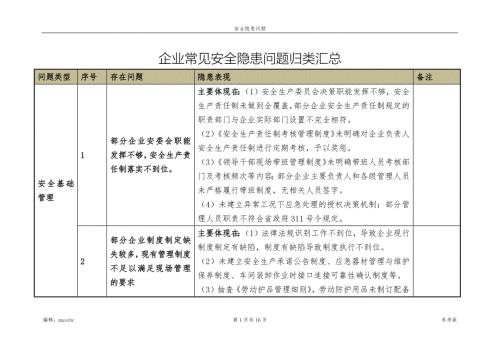
企业常见安全隐患问题归类汇总

特种设备安全事故应急预案附锅炉等专项预案

生产企业安全隐患问题排查表

特种设备安装、制造取(换)证迎接审查工作汇报
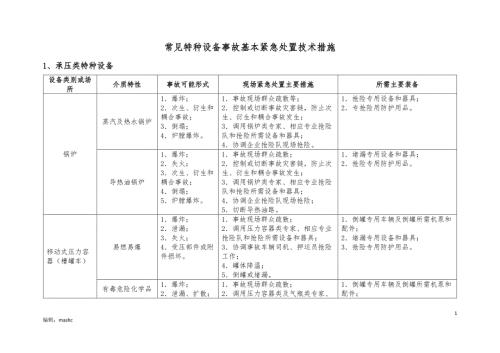
常见特种设备事故基本紧急处置技术措施

食品物料编码管理规程

食品生产企业库房管理制度

食品加工企业供方评价与选择管理制度
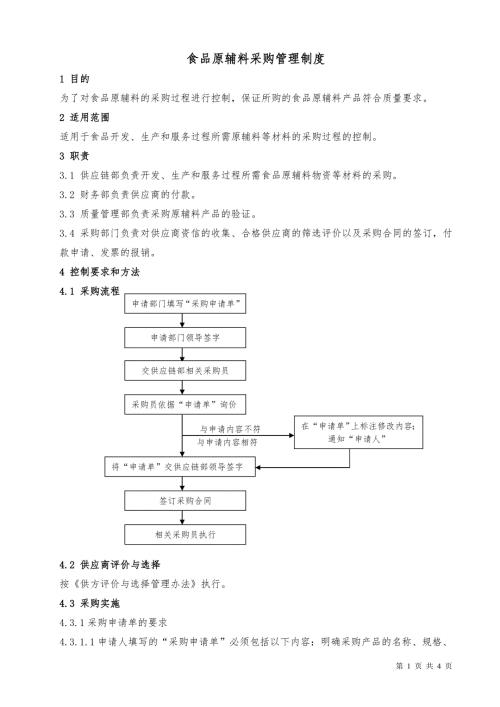
食品原辅料采购管理制度

锅炉能效测试作业指导书2024版
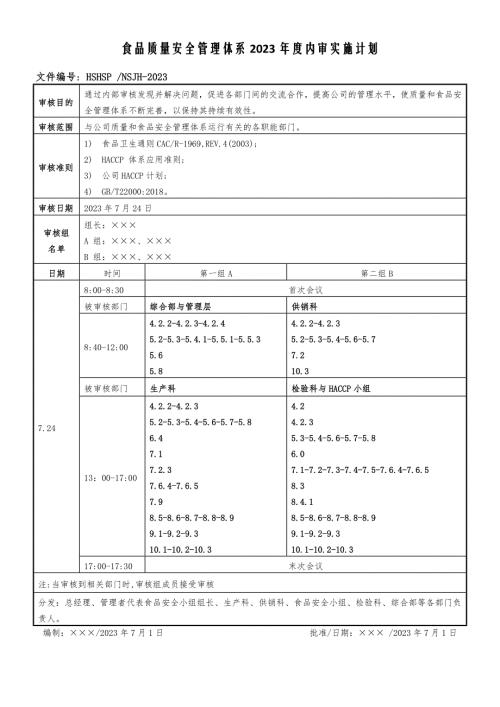
食品质量安全管理体系2023年度内审实施计划

食品生产企业“日管控、周排查、月调度”记录实例及其报告格式

食品质量安全体系2023年度内审资料汇编
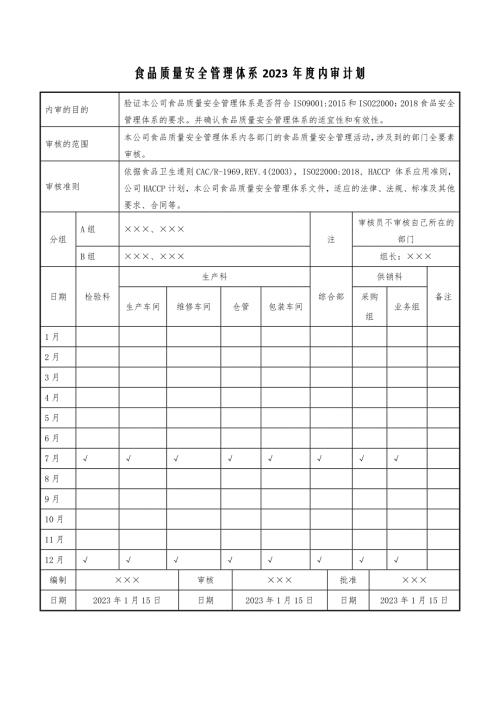
食品质量安全管理体系2023年度内审计划

食品质量安全管理体系内审不符合报告及其不符合项分布统计表

食品企业日管控周排查月调度记录及其报告格式参考

食品生产许可申请书示例

食品(饮料)生产许可——饮料分类及饮料重点生产工艺

常见饮料分类及其工艺流程图
 CCAA 管理体系认证基础知识点汇编
CCAA 管理体系认证基础知识点汇编
2024-01-25 251页
 变更点管理程序
变更点管理程序
2023-12-25 6页
 2023福建省安全员C证考试题库附答案(推荐)
2023福建省安全员C证考试题库附答案(推荐)
2023-06-25 33页
 2023福建省安全员-C证考试题库
2023福建省安全员-C证考试题库
2023-06-25 33页
 2023福建省安全员-《A证》考试题库
2023福建省安全员-《A证》考试题库
2023-06-25 32页
 2023福建省安全员-C证考试(专职安全员)题库及答案
2023福建省安全员-C证考试(专职安全员)题库及答案
2023-06-25 32页
 2023福建省安全员知识题附答案
2023福建省安全员知识题附答案
2023-06-25 32页
 2023福建省安全员-C证考试(专职安全员)题库附答案
2023福建省安全员-C证考试(专职安全员)题库附答案
2023-06-25 33页
 2023年陕西安全员考试题及答案
2023年陕西安全员考试题及答案
2023-06-25 32页
 2023年陕西安全员C证(专职安全员)考试题
2023年陕西安全员C证(专职安全员)考试题
2023-06-25 32页

