
lewis酸碱理论
3页1、Lewis酸碱理论理论发展布朗斯特酸碱理论概念的核心系于分子或离子间的质子转移,显然无法对不涉及质子转移,但却具有酸碱特征的反应做解释.这一不足在布朗斯特概念提出的同年由美国化学家路易斯提出的 酸碱电子理论(the electronic theory of acid and alkali),也称广义酸碱理论、路易斯(lewis)酸碱理论,是1923年美国物理化学家吉尔伯特牛顿路易斯(Lewis G N)提出的一种酸碱理论,它认为:凡是可以接受外来电子对的分子、基团或离子为酸;凡可以提供电子对的分子、离子或原子团为碱。这种理论包含的酸碱范围很广,但是,它对确定酸碱的相对强弱来说,没有统一的标度,对酸碱的反应方向难以判断。后来,皮尔逊提出的软硬酸碱理论弥补了这种理论的缺陷。电子酸碱该理论认为:凡是能够接受外来电子对的分子、离子或原子团称为路易斯酸(Lewis acid),即电子对接受体,简称受体;凡是能够给出电子对的分子、离子或原子团称为路易斯碱(Lewis base),即电子对给予体,简称给体。或者说:路易斯酸(Lewis acid)是指能作为电子对接受体(Electron pair a
2、cceptor)的原子,分子,离子或原子团;路易斯碱(Lewis base)则指能作为电子对给予体(Electron pair donor)的原子,分子,离子或原子团;酸碱反应是电子对接受体与电子对给予体之间形成配位共价键的反应.路易斯酸的分类1、 配位化合物中的金属阳离子,例如Fe(H2O)63+和Cu(NH3)42+中的Fe3+离子和Cu2+离子.2、有些分子和离子的中心原子尽管满足了8电子结构,仍可扩大其配位层以接纳更多的电子对.如 SiF4 是个路易斯酸,可结合2个F的电子对形成 SiF62.3、另一些分子和离子的中心原子也满足8电子结构,但可通过价层电子重排接纳更多的电子对.再如CO2能接受OH离子中O 原子上的孤对电子4、某些闭合壳层分子可通过其反键分子轨道容纳外来电子对.碘的丙酮溶液呈现特有的棕色,是因为I2分子反键轨道接纳丙酮中氧原子的孤对电子形成配合物(CH3)2COI2.再如四氰基乙烯(TCNE)的*轨道能接受一对孤对电子。常见的Lewis酸:正离子、金属离子:钠离子、烷基正离子、硝基正离子受电子分子(缺电子化合物):三氟化硼、三氯化铝、三氧化硫、二氯卡宾分子中的极
《lewis酸碱理论》由会员cjc****537分享,可在线阅读,更多相关《lewis酸碱理论》请在金锄头文库上搜索。

城乡居民健康 档 案管理

中国近现代史纲要习题册2018.12 - 副本(一)

中 国 共 产 党入党积极分子考察表

华为的成功之路对我国企业的启示

惩罚犯罪与保障人 权的关系

人脸识别99%准确率背后的秘密

孔子思想的对国外的影 响 力

幼儿园 档 案管理

从网络直播和传统行业结合行业发展趋势分析网络主播未来生存发展之路
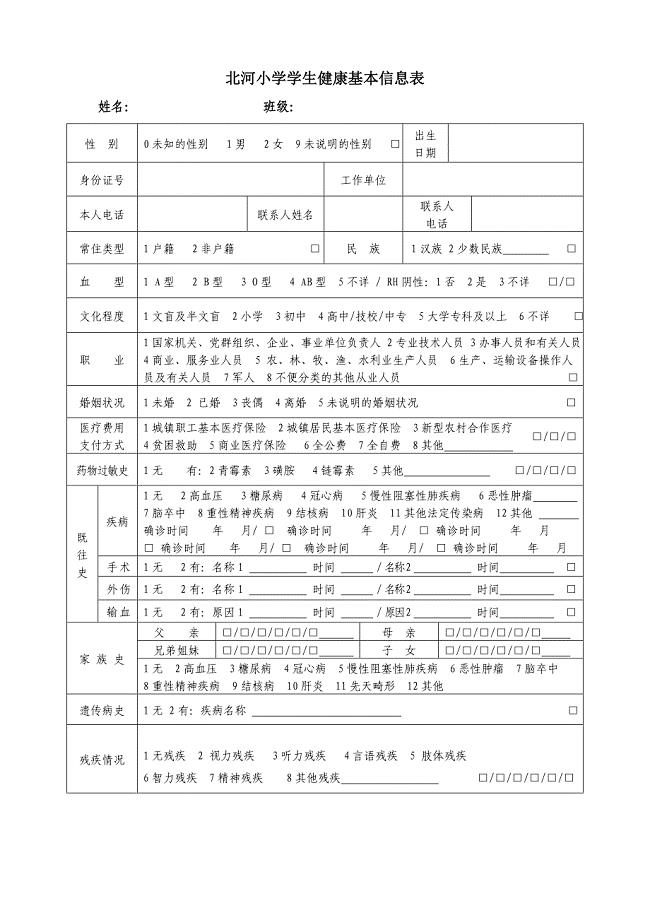
学生健康 档 案个人基本信息表

关于红 军长征的故事10个完整版

奇迹技术S12服务端经验倍率修改

一个很短的故事 海明威 翻译

《影 响 力从语言开始》作业及考试

我国土壤污染现状与防控策略

提高教师执教能力三 部 曲

《十六年前的回 忆》 重点问题探究

前诉裁判对后诉的影响——《民诉法解释》第93条、第247条解析

从《巴黎圣母院》感悟美与丑的真谛

三国演义常识题
 四川乐山盐源县卫生事业单位从“三支一扶”计划人员中招考聘用3人公开练习模拟卷(第4次)
四川乐山盐源县卫生事业单位从“三支一扶”计划人员中招考聘用3人公开练习模拟卷(第4次)
2023-02-25 64页
 2023年绍兴市第五医院”康复医学与技术“岗位招聘考试历年高频考点试题含答案解析
2023年绍兴市第五医院”康复医学与技术“岗位招聘考试历年高频考点试题含答案解析
2023-12-07 66页
 离婚答辩意见状范本(可编辑打印)
离婚答辩意见状范本(可编辑打印)
2023-08-22 2页
 2023年广西南宁市马山县古寨乡古寨社区工作人员考试模拟题及答案
2023年广西南宁市马山县古寨乡古寨社区工作人员考试模拟题及答案
2022-11-26 23页
 南开大学21春《国际商法》离线作业2参考答案18
南开大学21春《国际商法》离线作业2参考答案18
2023-10-28 11页
 2023年山东省菏泽市单县莱河镇社区工作人员考试模拟试题及答案
2023年山东省菏泽市单县莱河镇社区工作人员考试模拟试题及答案
2023-02-27 80页
 会计学原理试题含答案
会计学原理试题含答案
2023-07-18 16页
 云南玉溪峨山县机关事务服务中心招考聘用政府购买服务岗位6人模拟试卷【附答案解析】(第9期)
云南玉溪峨山县机关事务服务中心招考聘用政府购买服务岗位6人模拟试卷【附答案解析】(第9期)
2022-10-08 120页
 南开大学21春《法律文书写作》离线作业1辅导答案64
南开大学21春《法律文书写作》离线作业1辅导答案64
2023-11-03 11页
 西安交通大学21秋《企业财务管理》平时作业2-001答案参考79
西安交通大学21秋《企业财务管理》平时作业2-001答案参考79
2023-03-04 12页

