
2019年高考考前周周练之化学全真模拟卷(2)
13页1、2019年高考考前周周练之化学全真模拟卷(2)1、化学与生产、生活及社会发展密切相关,下列有关说法不正确的是( )A“血液透析”和“静电除尘”利用了胶体的不同性质B氨基酸在人体中生成新的蛋白质的反应属于缩聚反应C从海水中提取物质都必须通过化学反应才能实现D在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮2、迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如下图所示。下列叙述正确的是 ( ) A迷迭香酸的分子式为C18H15O8B迷迭香酸可以发生加成、取代、消去、显色反应C1mol迷迭香酸跟H2反应,最多消耗8mol H2D1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH3、NA为阿伏加德罗常数的值,下列说法错误的是( )A.128g HI加热充分分解生成氢气的分子数为0.5NAB.15g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NAC.标准状况下,1.12L氖气与1.12L甲烷所含质子总数均为0.5NA D.0.2mol CH4与0.5mol Cl2在光照下充分反应,产物中CC1键总数为0.5NA4、下表中元素均为中学化学中常见短周期元素,根据表
2、中信息,下列说法不正确的是()元素代号XYZWN原子半径/nm0.1860.0740.1020.0990.160主要化合价122、67、12A常温下单质与水反应速率:XNB最高价氧化物对应水化物酸性:WZCX和Y的单质在一定条件下反应可生成一种淡黄色的固体化合物D.X与W形成的化合物是共价化合物5、按如图装置进行实验,下列推断正确的是()选项中试剂中试剂及现象推断A氯化铵酚酞溶液不变红色氯化铵稳定B硫酸亚铁品红溶液褪色FeSO4分解生成FeO和SO2C涂有石蜡油的碎瓷片酸性高锰酸钾溶液褪色石蜡油发生了化学变化D铁粉与水蒸气肥皂水冒泡铁粉与水蒸气发生了反应6、如图所示,甲池的总反应式为。下列说法正确的是( )A.乙池中Pt电极上发生氧化反应B.乙池中石墨电极上发生的反应为C.甲池溶液pH增大,乙池溶液pH减小D.甲池中每消耗0.1mol ,乙池电极上则会析出6.4g固体7、常温下,的溶液与等浓度的NaOH溶液等体积混合后,所得溶液中部分离子及浓度如图所示,下列说法正确的是( )A.为强酸B.该混合溶液的C.X表示、Y表示D.混合溶液中:8、著名化学反应“法老之蛇”曾令无数人叹服,某兴趣小
3、组为探究分解产物的成分,在连接好如图所示装置,检验气密性后,点燃A处酒精灯。已知:沸点为-21.2,熔点为-34.4,化学性质与卤素单质相似,有剧毒,燃烧时火焰呈紫红色,边缘略带蓝色沸点为46.5,熔点为-111.9,能与酯互溶(1).仪器a的名称为_。(2).已知溶于水,可由KSCN溶液与溶液反应制得,并以作指示剂,则当溶液变为_色时,沉淀完全。(3).待A中固体充分分解后,取下B装置,B瓶中有无色液体,并有类似氯仿的芳香甜味,与酯混合能够互溶,经查证,B中液体为,可用于制造人造丝、杀虫剂,请举出一种其在实验室中的用途_。(4).取下C装置,点燃C中气体,气体燃烧火焰呈紫红色,边缘略带蓝色,则E中反应的化学方程式为_。(5)取下D装置,将燃着的镁条伸入瓶中,镁条会继续燃烧,取出燃烧产物,加入少量热水,产生的气体能使湿润的红色石蕊试纸变蓝,则证明分解产物中含有_。(6).取出A中剩余固体,加水溶解,固体不溶,加入王水固体溶解,则证明含有HgS。记溶解后的溶液为X。该固体_(填“能”或“不能”)溶于稀盐酸,原因是_。(7). 经上述推断,写出分解的化学方程式_。(8).若要测定的分解率,
《2019年高考考前周周练之化学全真模拟卷(2)》由会员七**分享,可在线阅读,更多相关《2019年高考考前周周练之化学全真模拟卷(2)》请在金锄头文库上搜索。
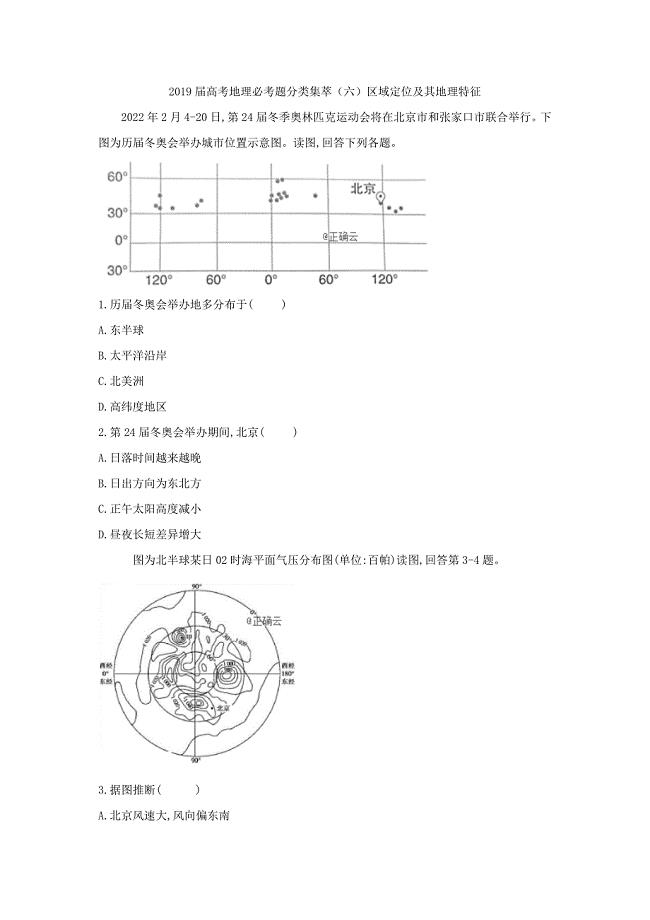
2019届高考地理必考题分类集萃:(六)区域定位及其地理特征

2019年高考考前周周练之化学全真模拟卷(2)

2019届高三高考物理章节验收卷:相互作用

2019届高考政治预热练习卷八

2019届高三高考物理章节验收卷:牛顿运动定律

2019年高考考前周周练之化学全真模拟卷(3)

2019届高三高考物理章节验收卷:恒定电流
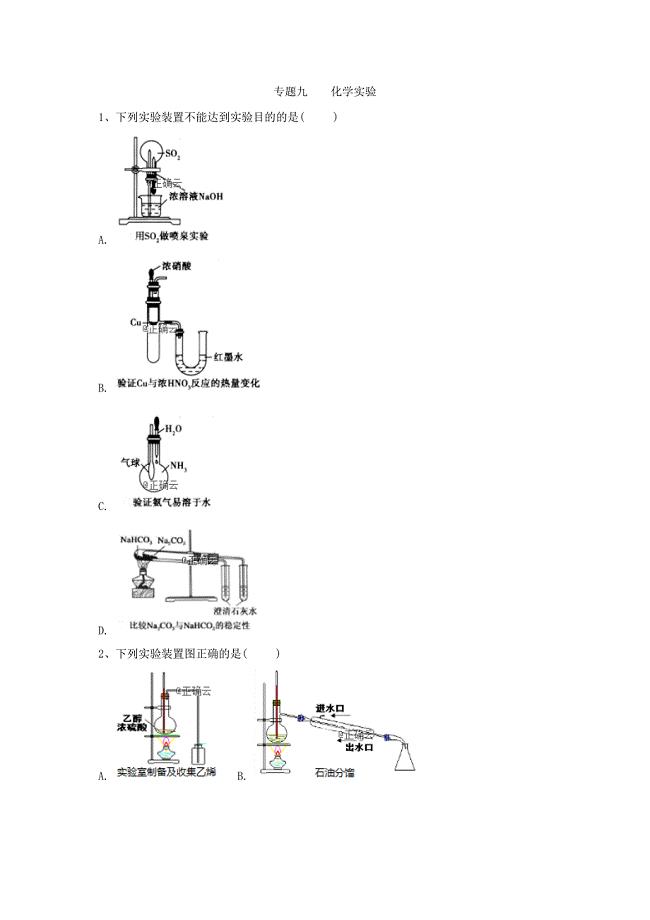
2019年高考化学考前闯关练习:专题九化学实验

2019年高考化学考前闯关练习:专题五氧化还原

2019届高考政治预热练习卷二

2019届高考政治考前查漏补缺卷五

2019届高考政治考前查漏补缺卷七

2019年高考化学考前闯关练习:专题七电解质

2019届高考政治预热练习卷一

2019年高考化学考前闯关练习:专题三化学计量计算

2019年高考考前周周练之化学全真模拟卷(1)

2019届高考政治预热练习卷四
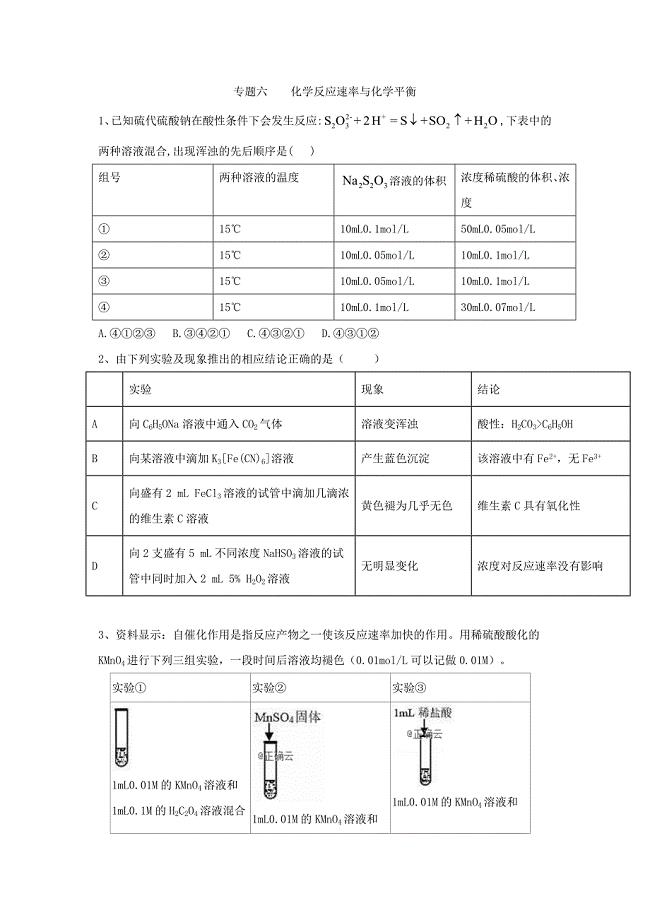
2019年高考化学考前闯关练习:专题六化学反应速率与化学平衡

2019届高考政治考前查漏补缺卷六

2019年高考化学考前闯关练习:专题四离子反应
 湖北省部分普通高中联盟2023-2024学年高二下学期期中考试地理试卷
湖北省部分普通高中联盟2023-2024学年高二下学期期中考试地理试卷
2024-04-26 16页
 第22天 disadvantage~downtown(词形转换+单句填空+熟词新意+写作应用+原创语填)教师版
第22天 disadvantage~downtown(词形转换+单句填空+熟词新意+写作应用+原创语填)教师版
2024-04-26 7页
 安徽省2023-2024学年高三上学期开学摸底大联考化学(解析版)
安徽省2023-2024学年高三上学期开学摸底大联考化学(解析版)
2024-04-26 22页
 第23天 downward~eat(词形转换+单句填空+熟词新意+写作应用+原创语填)教师版
第23天 downward~eat(词形转换+单句填空+熟词新意+写作应用+原创语填)教师版
2024-04-26 7页
 安徽省合肥市庐巢联盟2023-2024学年高一下学期第一次集体练习历史试题 Word版含解析
安徽省合肥市庐巢联盟2023-2024学年高一下学期第一次集体练习历史试题 Word版含解析
2024-04-26 12页
 第25天 energetic~ever(词形转换+单句填空+熟词新意+写作应用+原创语填)教师版
第25天 energetic~ever(词形转换+单句填空+熟词新意+写作应用+原创语填)教师版
2024-04-26 7页
 湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高一下学期期中联考数学Word版含解析
湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高一下学期期中联考数学Word版含解析
2024-04-26 10页
 湖北省2024届普通高等学校招生适应性考试(七)历史试题 Word版含解析
湖北省2024届普通高等学校招生适应性考试(七)历史试题 Word版含解析
2024-04-26 13页
 湖北省部分普通高中联盟2023-2024学年高二下学期期中考试地理试卷解析
湖北省部分普通高中联盟2023-2024学年高二下学期期中考试地理试卷解析
2024-04-26 1页
 浙江省金华市十校2023-2024学年高三下学期4月模拟考试化学试题 Word版含解析
浙江省金华市十校2023-2024学年高三下学期4月模拟考试化学试题 Word版含解析
2024-04-26 24页

