
【同步导学】高中化学 2.1.1练习 苏教版必修2
4页1、2012新课标同步导学高一化学练习:2.1.1(苏教版必修2)(本栏目内容,在学生用书中以活页形式分册装订!)一、选择题1下列措施对增大反应速率明显有效的是()ANa与水反应时增大水的用量BFe与硫酸反应制取H2时,适当加热C在K2SO4与BaCl2两溶液反应时,增大压强DAl在氧气中燃烧生成Al2O3,将铝片改为铝粉【解析】A项,水为纯液体,浓度为常数,增大水的量,反应速率不变;B项,升高温度,反应速率加快;C项,对于有气体参加的反应,增大压强,反应速率才加快;D项,铝片改成铝粉,增大了与O2的接触面积,反应速率加快。【答案】BD2加热氯酸钾制氧气时,在锰、二氧化锰、高锰酸钾中,可以作催化剂的是()ABC D【解析】如果对催化剂的概念模糊不清,认为只要能使氯酸钾受热分解速率加快的物质就是该反应的催化剂(其中锰与氯酸钾受热分解产生的氧气反应生成二氧化锰,高锰酸钾的分解也能产生二氧化锰),就会掉进命题人设置的“陷阱”错选B。其实催化剂的概念包含两层意思:(1)改变反应速率;(2)反应前后本身的质量和化学性质不变。【答案】C3反应C(s)H2O(g)CO2(g)H2(g)在一个可变容积的密
2、闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()A增加C的量B将容器的体积缩小为原来的一半C保持体积不变,充入N2使体系压强增大D保持压强不变,充入N2使容器体积增大【解析】C选项中充入N2使体系压强增大,但容器的容积未发生改变,参加反应的各种气体的浓度未发生改变,故反应速率不变。D选项中保持压强不变,充入N2使容器体积增大,参加反应的各种气体的浓度减小,反应速率减小。【答案】AC4四个不同容器在不同条件下进行合成氨反应,根据下列在相同时间内测定的结果判断,生成氨的速率最快的是()A用H2表示的反应速率为0.1 molL1min1B用N2表示的反应速率为0.04 molL1s1C用N2表示的反应速率为0.2 molL1s1D用NH3表示的反应速率为0.3 molL1s1【解析】解决此类问题时,可将不同物质表示的速率换算成用同一物质表示的速率,再比较速率之间数值的大小。本题以N2为标准,将其他物质表示的速率换算成用N2表示的速率,换算时注意速率的单位要统一。【答案】C5100 mL 6 molL1的H2SO4跟过量锌粉反应,在一定温度下,要想减缓反应进行的速率,但又不影响生成的
3、氢气的总量,可向反应物中加入适量的()A硫酸钠固体 B水C硫酸钾溶液 D硝酸钾溶液【解析】减缓反应速率,可以降低c(H),同时不减少H的物质的量,D选项中加入硝酸钾溶液会使溶液具有强氧化性(相当于HNO3),反应不能生成氢气。【答案】BC6将5.6 g铁粉投入足量的100 mL 2 mol/L稀硫酸中,2 min时铁粉刚好完全溶解。下列有关这个反应的反应速率表示正确的是()A铁的反应速率0.5 mol/(Lmin)B硫酸的反应速率0.5 mol/(Lmin)C硫酸亚铁的反应速率0.5 mol/(Lmin)D氢气的反应速率0.5 mol/(Lmin)【解析】根据反应速率计算公式,要计算2 min时间内反应物浓度的变化量,在反应:FeH2SO4=FeSO4H2中,溶液中溶质浓度发生变化的只有反应物硫酸和生成物硫酸亚铁。5.6 g Fe的物质的量0.1 mol,故反应消耗H2SO4的物质的量生成FeSO4的物质的量0.1 mol。H2SO4的消耗速率FeSO4的生成速率0.5 mol/(Lmin)。【答案】BC7已知某反应的各物质浓度数据如下:aA(g)bB(g)2C(g)起始浓度(molL
《【同步导学】高中化学 2.1.1练习 苏教版必修2》由会员1506****555分享,可在线阅读,更多相关《【同步导学】高中化学 2.1.1练习 苏教版必修2》请在金锄头文库上搜索。

绿地集团平面广告评比总结报告-08月 (NXPowerLite)
年最新韩国风格ppt图表模板
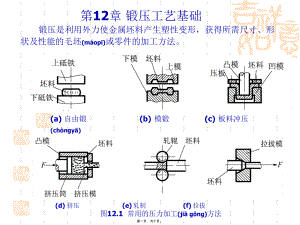
金属材料及工艺---第12章 锻压工艺基础

重组与3G凸显电信业投资机会

道顺咨询中国公民旅游市场调查报告

西安高新70万㎡阳光金城年度推广

蓝白配色高端商务工作总结PPT模板

腾讯年手机安全报告_企鹅智酷

职业技能鉴定培训—DV创意与策划

糖尿病患者心血管疾病标准药物治疗
硫化氢(H2S)培训讲义

研究分析报告:中国移动母婴产品发展形势分析

清新绿色商务总结汇报动态ppt模板

深圳永豪GPS手持行业应用解决方案
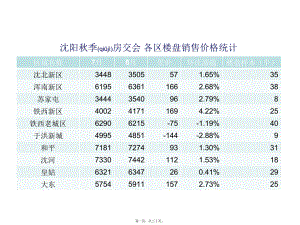
沈阳商品房住宅数据

沃尔玛培训-0923超市生鲜经营模式研讨会培训-F

汽车维修技术培训---发电机

欧派二十周年感恩庆典方案

欧普康视手机下单系统APP-研发部

某某煤炭工业集团公司年会活动策划方案
 高考数学微专题之概率与统计
高考数学微专题之概率与统计
2024-05-05 95页
 2024年吉林省中考语文二轮专题复习指导与强化训练:课内外文言文比较阅读(后附专题复习指导策略)
2024年吉林省中考语文二轮专题复习指导与强化训练:课内外文言文比较阅读(后附专题复习指导策略)
2024-05-05 104页
 工贸企业储存、使用危险化学品安全指导手册
工贸企业储存、使用危险化学品安全指导手册
2024-05-05 59页
 2024届高考英语应用文写作清单
2024届高考英语应用文写作清单
2024-05-03 9页
 2024年高考语文第二轮专题复习强化训练:语言文字运用(附答案)+(1)
2024年高考语文第二轮专题复习强化训练:语言文字运用(附答案)+(1)
2024-05-03 13页
 2024届高考英语阅读理解高频词(共13类402个)清单
2024届高考英语阅读理解高频词(共13类402个)清单
2024-05-03 5页
 2024届高考语文专项考点通关训练:词语的辨析
2024届高考语文专项考点通关训练:词语的辨析
2024-05-03 15页
 2024届高三上学期基础知识背默大赛试题
2024届高三上学期基础知识背默大赛试题
2024-05-03 6页
 2024届语文高考考前练——名篇名句默写
2024届语文高考考前练——名篇名句默写
2024-05-03 5页
 2024届高考语文一轮复习专题强化训练:病句的辨析与修改
2024届高考语文一轮复习专题强化训练:病句的辨析与修改
2024-05-03 18页

