
药品生产质量管理检查要点指南
38页1、药品生产质量管理检查要点指南一、概述 药品生产是产品实现过程,是药品GMP的重要组成部分。生产管理应建立在人、机、料、法、环统一协调基础上。生产过程控制是生产管理的重要任务,生产过程控制要建立在工艺设计的基础上,剂型不同,所涉及的生产和过程控制的要求不同。但是总的生产和过程控制的原则是一致的;通过充分的设计和评估最大限度降低药品生产过程中的污染、交叉污染以及混淆、差错等风险,保持续稳定地生产出符合预定用途和注册要求的药品。与1998年修订药品GMP相比,新修订药品GMP生产管理章节内容更加规整、详细,将1998年修订GMP生产管理章节中的第六十八条、第六十九条、第七十条、第七十三条等条款延用,放在本章节第一节原则中,增加防止生产过程中的污染和交叉污染措施、生产操作、包装操作等具体要求,规范涉及生产相关文件、物.料平衡、批记录填写、生产批次划分与批号编制、防止污染和混淆措施等。二、检查要点(一)原则第一百八十四条所有药品的生产和包装均应当按照批准的工艺规程和操作规程进行操作并有相关记录,以确保药品达到规定的质量标准,并符合药品生产许可和注册批准的要求。 产品(包括中间产品、待包装产品及成
2、品)是否经过质量检验确认符合企业内控质量标准。 产品生产和包装全过程是否符合现行工艺规程和操作规程的要求,可通过对批生产记录、批包装记录以及相关操作记录的检查予以确认。检查时需注意:是否存在超出许可生产范围的严重情况。实际生产批量是否与工艺规程规定一致,是否存在任意变更批量的情况。实际包装形式与规格是否与工艺规程要求一致。第一百八十五条应当建立划分产品生产批次的操作规程,生产批次的划分应当能够确保同一批次产品质量和特性的均一性。是否诵过文件明确“批”的概念。“批”概念的设置是否合理,能否保证批内产品质量和特性的均一性。检查时需注意:可通过查阅批生产记录确认实际生产过程中对“批“概念的执行是否符合要求。是否存在亚批的管理情祝,是否按产品特性要求对“批”进行管理,例如:注射剂灭菌按批次进行取样。是否存在多个小批混合成大批的情况,是否具有大批质量均一性的证明资料。第一百八十六条应当建立编制药品批号和确定生产日期的操作规程。每批药品均应当编制唯一的批号。除另有法定要求外,生产日期不得迟于产品成型或灌装(封)前经最后混合的操作开始日期,不得以产品包装日期作为生产日期。 是否通过文件确定批号(包括
3、亚批)偏码原则,批号编码能否保证唯一性和产品可追溯性, 是否通过文件确定生产日期设置原则,生产日期的设置不能迟于产品成型或灌装(封)前经最后混合的操作开始日期,不得以产品包装日期作为生产日期。检查时需注意:可通过查阅批生产记录确认实际生产过程中批号和生产日期设置是否符合文件要求,特别是中间产品批号和生产日期的设置情况。若存在待包装产品长期贮存的情况,需特别关注其成品生产日期的设置情况,是否存在以内包日期为生产日期的情况。第一百八十七条每批产品应当检查产量和物料平衡,确保物料平衡符合设定的限度。如有差异,必须查明原因,确认无潜在质量风险后,方可按照正常产品处理。 是否通过文件(一般为工艺规程)确定每个品种的产量、物料平衡的计算方法和限度。 是否通过文件规定超出物料平衡限度的处理流程及异常批产品的处理流程。 是否对异常批产品进行质量风险评估。 是否保存差异或偏差处理记录、异常批评价及特殊处理或放行记录。检查时需注意:是否正确理解“收率”与“物料平衡”的概念及管理目的,“物料平衡”为所有可见产出与投入的比值,物料平衡的计算是为了防止物料误用和非正常流失;“收率”为合格产品与投入的比值。收率计
4、算是为控制生产成本。是否对包装岗位进行了物料平衡计算。对物料平衡的确认,有无质量管理部门或车间主管人员的审核。第一百八十八条不得在同一生产操作间同时进行不同品种和规格药品的生产操作,除非没有发生混淆或交叉污染的可能。是否存在同一操作间同时生产不同品种、不同规格或不同批号产品的情况。生产过程防护措施能否有效避免混淆、差借、污染和交叉污染的发生。检查时需注意:企业有无文件明确规定,不同品种、规格的生产操作不得在同一操作间同时进行。现场检查制剂生产是否能做到单机单间,一室内有多台设备的查批生产记录,是否存在差错可能。药材的拣选、洗涤、浸润、切制、干燥、粉碎等是否分时、分室操作,或采取有效措施防止污染和混淆。第一百八十九条在生产的每一阶段,应当保护产品和物料免受微生物和其他污染。是否通过文件对产品和物料的微生物防护措施进行明确规定并执行。是否对生产过程中的微生物情况进行评估并规定有针对性的避免微生物污染的措施,特别是无菌制剂生产过程。是否具有明确的生产环境、设备、器具等消毒或灭菌程序并执行。检查时需注意:是否规定有防止产生的气体、蒸汽、喷雾物或微生物等引起交叉污染的有效措施。是否明确规定了无菌
《药品生产质量管理检查要点指南》由会员万****分享,可在线阅读,更多相关《药品生产质量管理检查要点指南》请在金锄头文库上搜索。

排水整治工程确保安全生产的技术组织措施

隧道辖区道路清扫保洁劳务保洁服务针对低温天气作业应急预案

电气安装焊接工程强制性条文执行情况检查表

隧道辖区道路清扫保洁劳务保洁服务项目机械化保洁及垃圾清运过程应急处理预案

隧道辖区道路清扫保洁劳务保洁服务应急救援保障措施

城镇燃气经营安全重大隐患判定标准

市政道路及各项基础设施配套项目项目管理班子的人员岗位职责分工

养驴基地建设项目建设的有利条件和制约因素

养驴基地建设项目区基本情况及项目由来

锅炉受热面焊接工程强制性条文执行情况检查表

锅炉受热面焊接工程强制性条文执行情况检查表 (2)

烟风煤粉管道及附属结构焊接专业强制性条文执行情况记录检查表

养驴基地建设项目财务评价方案
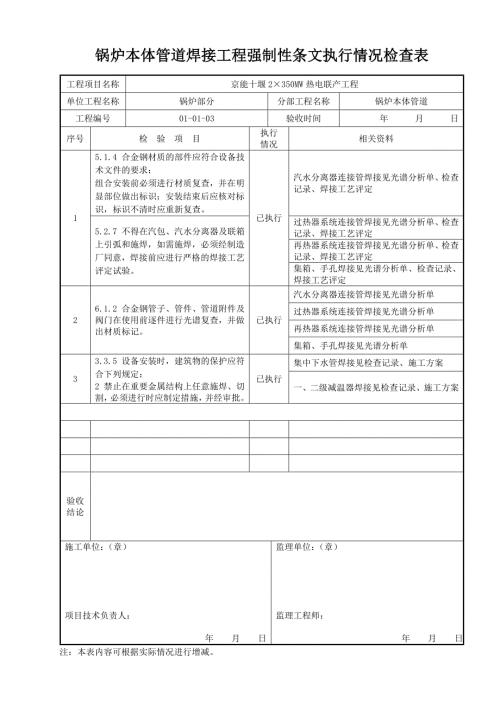
锅炉本体管道焊接工程强制性条文执行情况检查表 (2)

养驴基地建设项目环境保护评价方案

锅炉本体管道焊接工程强制性条文执行情况检查表

锅炉密封焊接工程强制性条文执行情况检查表 (2)

养驴基地建设项目建设内容方案

锅炉密封焊接工程强制性条文执行情况检查表 (3)

养驴基地建设项目管理方案
 企业安全费用投入保障制度
企业安全费用投入保障制度
2020-08-07 3页
 企业危险化学品储运管理制度
企业危险化学品储运管理制度
2020-08-07 3页
 新建改建扩建工程项目的安全论证评价和管理制度
新建改建扩建工程项目的安全论证评价和管理制度
2020-08-07 3页
 企业隐患整改制度
企业隐患整改制度
2020-08-07 2页
 化学品仓库的管理制度
化学品仓库的管理制度
2020-08-07 5页
 政工部门与及人员安全生产职责
政工部门与及人员安全生产职责
2020-08-07 3页
 污染源在线监控系统管理办法
污染源在线监控系统管理办法
2020-08-07 3页
 保卫部门及人员安全生产职责
保卫部门及人员安全生产职责
2020-08-07 2页
 分管经营负责人安全生产职责
分管经营负责人安全生产职责
2020-08-07 2页
 临时用电管理规程
临时用电管理规程
2020-08-07 3页

