
2020届全国高考化学:第三单元 主题7 铁、铜及其重要化合物 金属的冶炼学案 含答案
58页1、主题7:铁、铜及其重要化合物金属的冶炼:j回|j|p:命题铁单质和铁的化合物的性质和应用1 .判断正误(正确的打”,错误的打X)0(1) lOOmLlmohL-iFeCb溶液中所含 Fe3+的数目为0.1。()(2) 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化,可探究维生素C的还原性。()(3) 向FeCL溶液中滴加NFUSCN溶液,溶液显红色。()(4) 向CuSO4溶液中加入铁粉,有红色固体析出,可说明Fe2+的氧化性强于CW+的氧化性.()Al_(201Fe2O3(s)前Fe型口FeCl3(aq)在给定条件下,物质间的转化均能实现。()(6)某溶液中滴加K3Fe(CN)6溶液,产生蓝色沉淀,可得出原溶液中有Fe?+,无Fe3+.()(2()1”;:;Fe温FeCI2a理也Fe(0H)2中的反应均能实现。()(8) 向2 mL 0.1 moM_i的FeCb溶液中加足量铁粉振荡,加1滴KSCN溶液。若黄色逐渐消失,加KSCN溶液颜色不变,则证明还原性:FeFe2+。()(9) 酸性氯化亚铁溶液中加入双氧水的离子方程式为2Fe2+ H2O22Fe3+O2t+
2、2H+.()(10) 在 GFe2+)=lmolLi的溶液中能大量存在 K NHMn04. SO:。()(11) 1 mol Fe溶于过量硝酸,电子转移数为2Nm)。(12) 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释。()(13) FeCb腐蚀Cu刻制印刷电路板,能体现出铁比铜金属性强。()。(14) 常温下,将铁片浸入足量浓硫酸中,铁片不溶解,说明常温下,铁与浓硫酸一定没有发生化学反应。()(15) 2016 H上汨,21)Fe与Cb反应生成FeCb,推测Fe与L反应生成Feb.()(16) 室温下,向FeCh溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色说明Fe3+的氧化性比b的强。().(17) 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,现象是有气体生成,溶液呈血红色,说明稀硝酸将Fe氧化为Fe3+。()(18) 3 moi单质Fe完全转变为Fe3O4,失去8M个电子。()(19) 如下所示的物质间转化能一步实现:Fe2O3驾FeCb(aq)型无水FeCI3o ()(20) 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色,则溶液中一定含有 Fe
3、2+.()【答案】(l)x (2)V (3)x (4)x (5)x (6)x (7)x (8)V (9)x (10)x (11)x (12)V(13) x (14) x (15)x (16)V (17) x (18)V (19) x (20) x2. 由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿帆(FeSO4-7H2。),再通过绿帆制备铁黄FeO(OH)的流程如下:酸溶FeS,_.氨水/空气烧渣丁丁溶液绿帆L铁黄已知:FeS2和铁黄均难溶于水。下列说法不无碉的是().A.步骤,最好用硫酸来溶解烧渣B.步骤,涉及的离子方程式为FeS2+14Fe3+8H2。一15Fe2+2SO:+16H+C.步骤,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿研D.步骤,反应条件控制不当会使铁黄中混有Fe(OH)3【解析】制取绿帆,为防止引入新杂质,步骤最好用硫酸来溶解烧渣,A项正确;酸溶后得到的溶液中含有铁离子,会氧化FeS2中的硫元素,步骤中涉及的离子方程式为FeS2+14Fe3+8H2。15Fe2+2S0:+16H+,B项正确;亚铁离子易被氧化,直接加热会产生硫酸铁杂质
4、,C项错误;步骤,若反应条件控制不当,例如碱性太强,会使铁黄中混有Fe(OH)3,D项正确。【答案】C3. K3Fe(C2O4)33H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:(1)晒制蓝图时,用K3Fe(C2O4)3-3H2O作感光剂,以K31Fe(CN)6溶液为显色剂。其光解反应的化学方程式为:2K3Fe(C2O4)3%2FeC2O4+3K2C2O4+2CO2T;显色反应的化学方程式为.(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。通入氮气的目的是.实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有、.为防止倒吸,停止实验时应进行的操作是.样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FezCh存在的方法 id.,At*o【解析】Q)光解反应生成的FeCzCM草酸亚铁)遇到K3Fe(CN)6会产生有特征蓝色的沉淀,所以显色反应的化学方程式为3FeC2(D4+2K3Fe(CN)6Fe3Fe(CN)62l+3K2C2O4.装置中的空气在高温下能氧化金属铜,影响E中的反应,所以反应前
《2020届全国高考化学:第三单元 主题7 铁、铜及其重要化合物 金属的冶炼学案 含答案》由会员夏**分享,可在线阅读,更多相关《2020届全国高考化学:第三单元 主题7 铁、铜及其重要化合物 金属的冶炼学案 含答案》请在金锄头文库上搜索。

2023学校消防安全工作总结标准范文(7篇).doc

行政文员个人工作年终总结范本(3篇).doc
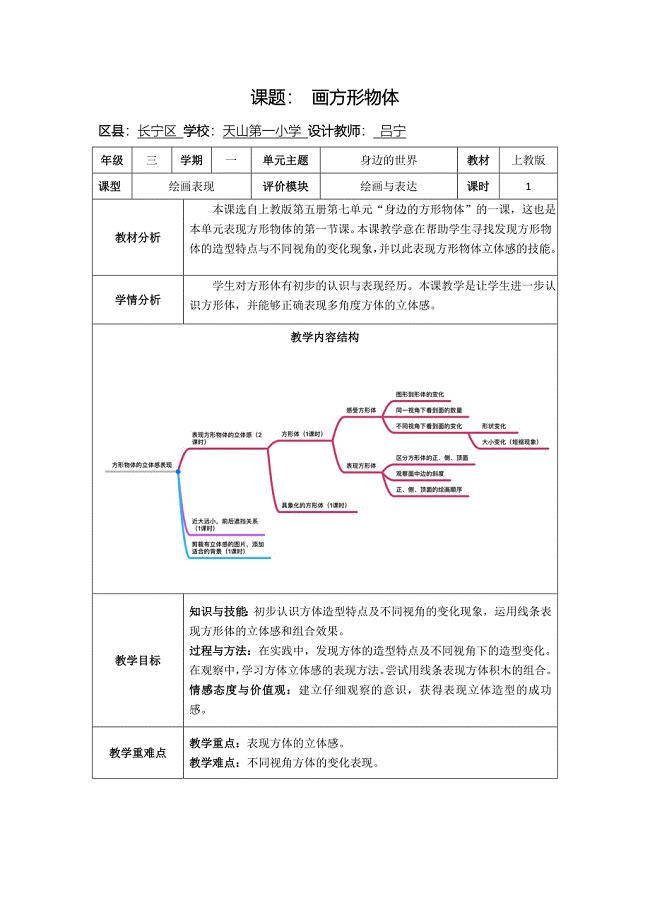
17 身边的方形物体1

精品高考化学二轮复习 专题14 铁、铜及其化合物练习

酒店管理职业生涯规划书范文

《城南旧事》读后感(15篇)【新版】

农村基层干部怎样做好新形势下的农村工作.doc

宜宾泡沫塑料包装材料项目建议书范文参考

2023年安徽六安市中医院第二批高层次人才招考聘用笔试参考题库附答案详解

双江县关于成立精细化工公司可行性分析报告(模板)

劳山区实施“小学生蓓蕾读书工程”汇报材料

03 船舶碰撞演习

教育学教育学预习报告

银行柜员工作总结怎么写

出租主体变更三方协议官方版(九篇).doc

办公室文员个人工作总结范文(5篇)

聚氯乙烯塑料加工中的危害

人教版美术一年级上册《纸风铃》教案

全国版高考化学一轮复习第8章水溶液中的离子平衡第2节水的电离和溶液的酸碱性学案

围墙施工组织设计
 公司年会发言稿15篇
公司年会发言稿15篇
2023-12-03 42页
 《花木兰》教学反思
《花木兰》教学反思
2023-02-14 3页
 人教版美术一年级上册《纸风铃》教案
人教版美术一年级上册《纸风铃》教案
2022-08-13 2页
 透析病人生活指导手册Word
透析病人生活指导手册Word
2022-08-27 27页
 高中化学第三章有机合成及其应用合成高分子化合物第三节合成高分子化合物学案1鲁科版选修5
高中化学第三章有机合成及其应用合成高分子化合物第三节合成高分子化合物学案1鲁科版选修5
2022-12-18 26页
 工伤级别鉴定标准
工伤级别鉴定标准
2023-09-09 23页
 中国巨力索具产品目录部分内容
中国巨力索具产品目录部分内容
2023-09-15 27页
 Word替换--实用高效率
Word替换--实用高效率
2023-06-26 4页
 三年级上册语文期中试卷轻巧夺冠235_1516苏教版(无答案)
三年级上册语文期中试卷轻巧夺冠235_1516苏教版(无答案)
2023-11-25 3页
 骨科下半年工作计划
骨科下半年工作计划
2022-12-04 23页

