
硬软酸碱理论
17页1、酸碱理论,,软硬酸碱的分类及原则,1. 软硬酸碱的分类 软硬酸碱是对路易斯酸碱的进一步分类。根据路易斯酸的受电子原子和路易斯碱的给电子原子的特点,把它们保持价电子能力的强和弱分别称为硬和软。,酸有三类:一类称为硬酸,它的特点是金属或其它接受电子原子的体积小,正电荷高,没有易变形和易失去的电子,也就是接受电子对外层电子抓的紧。另一类称为软酸,它的特点是金属或其它接受电子原子体积大,正电荷低或等于零,有若干易变形或易失去的电子,也就是接受电子原子对外层电子抓的松。最后某些酸对外层电子抓的松紧的程度介于硬酸和软酸之间,称为交界酸。三类酸的举例见表10-8,表10-8 酸的软硬分类,H+ Li+ Na+ K+Mg2+ Ca2+ Sr2+ Ba2+硬酸 Al3+ Cr3+ Fe3+ Co3+Ti4+ Mn4+ Mn2+BF3 SO3 CO2Fe2+ Co2+ Ni2+ Cu2+ 交界酸 Zn2+ Pb2+ Sn2+ Sb3+ Bi3+ SO2Cu+ Ag+ Cd2+Pt2+ Hg2+ Pd2+ Tl3+ 软酸 I+ Br+I2 Br2 S某些金属原子(Fe、Ni),软度增加,碱亦有三类:一类称为
2、硬碱,它的特点是碱中的给电子原子不易失去电子,电负性高,难变形不易被氧化,即对外层电子的吸引力强。另一类称为软碱,它的特点是碱中的给电子原子易失去电子,易极化变形,电负性小即原子对外层电子的吸引力弱。性质介于软、硬之间的碱称为交界碱。三类碱的举例见表10-9。,表10-9 碱的软硬分类,H2O OH- O2- F- CH3COO- 硬碱 PO43- Cl- CO32- SO42-ClO4- NO3- NH3交界碱 Br- NO2- SO32-H- SCN- 软碱 COCN- I- HS- S2O32- S2-,软度增加,必须指出:软硬酸碱的分类不但与元素的性质相关,而且与它们的氧化态也有关,即随着其离子电荷的不同而改变。例如,Fe3+和Sn4+是硬酸,而Fe2+和Sn2+则为交界酸。Cu2+为交界酸而Cu+则为软酸。SO42-为硬碱,SO32-则为交界酸,S2O32-为软碱等。另外,与结合在酸碱上的基团也有影响。如:BH3为软酸,BF3为硬酸,而B(CH3)3则为交界酸。又如NH3为硬碱,C6H5NH2为交界碱。,2. 软硬酸碱原则及其应用 从大量的酸碱反应和酸碱络合物的性质中,总结出
《硬软酸碱理论》由会员jiups****uk12分享,可在线阅读,更多相关《硬软酸碱理论》请在金锄头文库上搜索。

建立安全生产长效机制-共创和谐平安输气管道

土石方爆破工程设计方案

康师傅百货商场制度汇编之退换货管理办法

庙头中学2012年中考百日誓师大会学生代表发言稿

围堰拆除爆破工程

华能洱源马鞍山风电场工程土石方爆破管理制度

国资委:全面开展管理提升活动-为培育世界一流企业奠定坚实基础

《专业技术人员职业发展与规划》电子书

应收票据审计方案
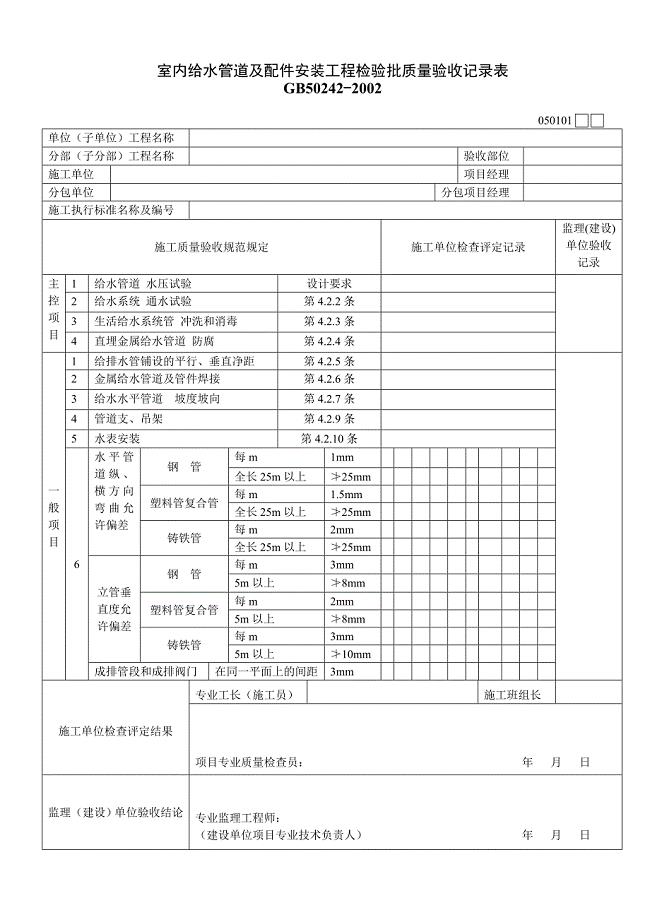
建筑给水排水与采暖工程质量验收用表

广播电视管理条例行政处罚裁量标准

广东电力系统调度运行操作管理规定

建筑给排水工程名词解释

幼儿园小班安全健康活动教案:宝宝误食后的急救

建业集团房屋建筑工程交房标准内容技术交底

建筑心理学论文(1)

康师傅百货商场制度汇编之工服管理程序009

建筑工程专业一级建造师继续教育培训结业报告20

廉洁风险防控回头看工作汇报材料

平台工作人员服务规范
 企业节后复工复产隐患排查
企业节后复工复产隐患排查
2024-05-02 56页
 机械作业安全知识
机械作业安全知识
2024-05-02 61页
 apqp 第3版 & 控制计划 第1版
apqp 第3版 & 控制计划 第1版
2024-04-08 20页
 消防器材及巡查要点
消防器材及巡查要点
2024-04-06 36页
 推动未来产业创新发展PPT课件
推动未来产业创新发展PPT课件
2024-02-09 36页
 职业病危害专项治理
职业病危害专项治理
2024-01-31 31页
 实现社会主义现代化和中华民族伟大复兴
实现社会主义现代化和中华民族伟大复兴
2024-01-28 18页
 小学高年级读本教学建议
小学高年级读本教学建议
2024-01-28 31页
 小学高年级读本编写思路和主要内容介绍
小学高年级读本编写思路和主要内容介绍
2024-01-28 24页
 筑牢坚不可摧的钢铁长城
筑牢坚不可摧的钢铁长城
2024-01-28 27页

