
第十二章药物制剂分析
20页1、第十二章 药物制剂分析基本要求掌握片剂、注射剂、胶囊剂、颗粒剂和软膏剂的一般检查项目和特殊检查项目;制剂含量测定结果的表示方法和计算方法。熟悉常用附加剂对含量测定的干扰和排除方法。了解复方制剂的分析。第一节 药物制剂分析的特点1. 方法:制剂分析是利用物理、化学、物理化学、甚至微生物测定方法,对 不同剂型的药物制剂进行分析,以检验被检测的制剂是否符合质量标准规定的要 求。2. 区别:制剂除含主药外,还含有赋形剂、稀释剂和附加剂(包括稳定剂、 抗氧剂、防腐剂和着色剂等),这些附加成分的存在,常常会影响主药的测定, 致使制剂分析复杂化。3. 检查:通常是符合药物规定要求的各种原料,按照一定的生产工艺制备而 成的。因此,在制剂分析中对所有原料所做过的检查项目,不必重复。制剂中如 需进行杂质检查,主要来源于制剂中原料药物的化学变化和制剂的制备过程。4. 制剂特殊检查:除对某些不稳定的药物制剂需增加必要的检查项目外,一 般对小剂量片剂(或胶囊)等需检查均匀度;对具有某种物理特性的片剂(或胶 囊)需检查溶出度;对某些特殊制剂(缓释、控释剂肠溶制剂)需检查释放度等 等,以保证药物的有效、合理及安全。
2、5.与原料药含量测定方法的区别:专属性和灵敏度要求更高。(考虑性质、含量以及赋形剂、附加剂的影响;同时考虑复方制剂中其他成分的影响)。6.计算:按标示量计算的百分含量表示,而不采用原料药的百分含量的表示 方法。1)采用滴定分析时,含量测定结果用下式进行计算:(1)片剂:相当于标示量的百分含量=w XW/n/W XS X100%测样 标式中,w为采用某种滴定方法测得的量(g) ; W/n为平均片(胶囊)重(g/测n片),w为称取样品量(g); n为所称取片(胶囊)的个数;S为标示量(g/样标片)(2)注射剂含量测定结果的计算:相当于标示量的百分含量= W /VXSX测100%式中V准确量取样品的体积(ml); W为采用某种滴定方法测得V (ml )样测品中被测组分的量(mg); S为标示量(mg/ml)。2)采用分光光度法时,含量测定结果按下式计算:(1)片剂含量测定结果计算:相当标示量的百分含量二AXDXVX(W/n) /Ei% X100XW XS 一X100%n1cm样 标式中,A为测得的吸收度;Ei%为吸收系数;D为稀释系数;W为称取样品1cm样量(g); V为将样品W溶解成准确的
3、体积(ml); S为标示量(g/片);样标(2)注射剂含量测定结果的计算:相当标示量的百分含S=AXDX10/Ei%icmX S X i00%标式中各符号均同上式中所示(mg/ml)。第二节 片剂和注射剂的分析(一)常规检查法1. 片剂的一般检查1)外观、色泽和硬度 完整光洁、均匀和适宜;2)重量差异(weightvariation)的检査指按规定称量方法测得每片的重 量与平均片重之间的差异程度。(1)重量差异限度平均片重 重量差异限度0.30g 以下 7.5%0.3g 以上(含 0.3g) 5%(2)检查法:取药片20片,精密称定总重量,求平均片重X后,再分别精 密测定各片的重量。每片重量和平均片重相比较(凡无含量测定的片剂,每片重 量应与标示片重比较),超出重量差异限度的药片不得多于 2片,并不得有一片 超出限度的一倍。糖衣片与肠溶片应在包衣前检查片芯的重量差异,符合规定后方可包衣。包 衣后不再检查重量差异。(3)注意事项:避免吸湿和污染。凡规定检查含量均匀度的片剂不再进行 重量差异的检查。3)崩解(disintegration)时限的检査:指固体制剂在规定的介质中,以规定的检查方
4、法进行检测,崩解溶散至小于2.0mm碎粒(或溶化、软化)所需的时 间限度。(1)检查装置:升降崩解仪 (2)检查方法:片剂、糖衣片、薄膜衣片或浸膏片、肠溶衣片、泡腾片各 有规定和方法。凡规定检查溶出度、释放度或融变时限的制剂,不再进行崩解时限检查。2. 注射剂的一般检查1)装量检查 灌封注射液式应按表适当增加装量,保证注射液用量不少于标 示量。除另有规定外,供多次用量的注射液,每一容器的装量不得超过 10 次注 射量,增加的装量应能保证每次注射用量。(1)检查方法2.0ml或以下者,取供试品5支;210.0ml, 3支;10.0以 上者, 2 支。干燥注射剂(预经标化),不得少于其标示量。2)无菌粉末的装量差异检查方法:5 支,除去标签、铝盖、容器外壁用乙醇洗净、干燥,开启时注意避 免玻璃等异物落入,分别迅速称定,倾出内容物,容器可用水、乙醇洗净,在适 宜条件下干燥,再分别称定。求出每 1 瓶(支)的装量与平均装量。比较,应符 合表的规定。3)澄清度检查 除另有规定外,按照卫生部标准规定进行检查,应符合规定。4)无菌检査:附录XIH项下的无菌检查法进行检查,应符合规定。5)pH值检査
《第十二章药物制剂分析》由会员工****分享,可在线阅读,更多相关《第十二章药物制剂分析》请在金锄头文库上搜索。

会所设置建议

华为_S2000_的配置全解

安徽省合肥市包河区2016年中考数学一模试卷含答案解析

公务员基层工作面试题答题要点

变压器预防性试验

肝门部胆管腔内射频消融相关并症活体实验观察

压缩式垃圾车液压系统设计【苍松书苑】

高温防暑降温安全工作总结模板(二篇).doc

评论《女娲补天》一课

南二水源雨季施工方案

人教版小学语文六年级上册经典复习资料

国外先进脱硫技术分析

教学反思 (4)

爆破技术员培训的考试试题【精选文档】

08重庆市建设工程费用定额

小学班主任培训工作总结
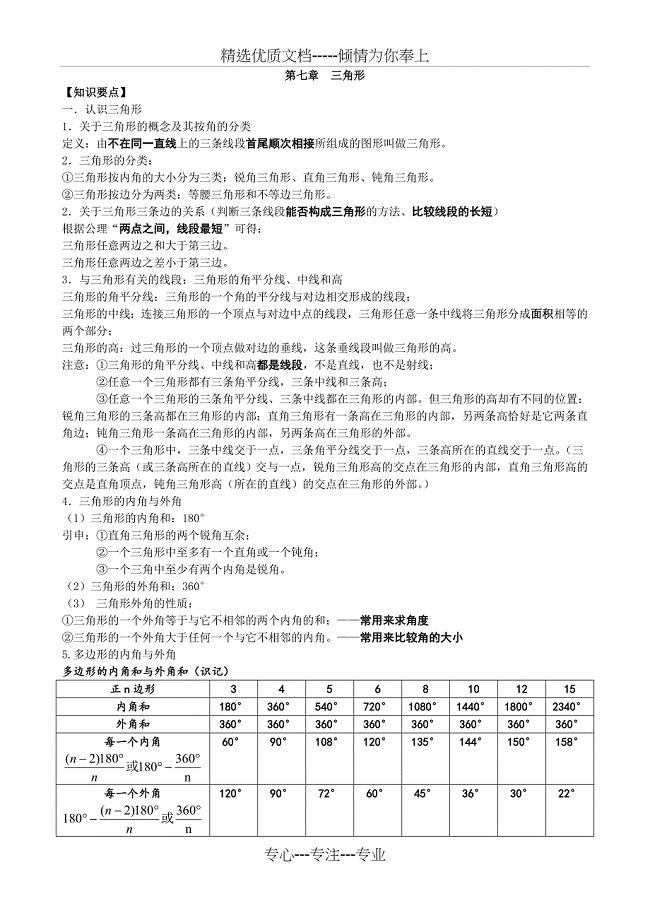
人教版八年级上数学第十一章-三角形-知识点+考点+典型例题

红楼梦读书心得(集合15篇)_1.doc

小班上学期教育目标

新溆高速项目简介
 家庭教育讲座心得体会范文(7篇)
家庭教育讲座心得体会范文(7篇)
2023-04-14 19页
 浅论公司组织结构引发的中小型企业管理学思考
浅论公司组织结构引发的中小型企业管理学思考
2023-11-28 4页
 基站天线及其在网络优化中的作用
基站天线及其在网络优化中的作用
2022-08-26 25页
 井架落地卸料平台的技术要求、允许偏差与检验方法
井架落地卸料平台的技术要求、允许偏差与检验方法
2022-07-15 1页
 10kV架空配电线路带电安装故障指示器
10kV架空配电线路带电安装故障指示器
2022-12-18 9页
 专题三:勾股定理与全等构造
专题三:勾股定理与全等构造
2022-12-15 6页
 国外先进脱硫技术分析
国外先进脱硫技术分析
2022-08-19 2页
 烯烃的亲电加成反应
烯烃的亲电加成反应
2023-09-21 15页
 2020年中学生纪律处分条例3篇
2020年中学生纪律处分条例3篇
2023-07-02 19页
 小叶紫檀的真假辨析及小叶紫檀二胡的分类
小叶紫檀的真假辨析及小叶紫檀二胡的分类
2022-12-09 2页

