
硫和氮的氧化物知识总结汇编
9页1、(一)硫俗称硫磺。1、硫的物理性质:淡黄色固体,难溶于水,可溶于酒精,易溶于CS2, 熔沸点都很低。2、硫的化学性质 氧化性:与绝大多数金属反应:Fe+S = FeSCu+注 C垃S与变价金属生成低价金属)2Na+S=NaS研磨并轻微爆炸)Hg+S=HgS除去有毒的Hg的方法)与非金属反应:H2+SH2S 还原性:与氧气发生反应S+Q虫SQ 自身氧化还原反应3S+6NaQH=2NaS+Na:SQ +3H2Q(二 )二氧化硫1、物理性质:二氧化硫是一种无色、有刺激性气味、有毒、比空气 重、容易液化、易溶于水的气体。2、化学性质可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反 应方向进行的反应,叫可逆反应。(1)酸性氧化物亚硫酐 二氧化硫与水反应:SQ + H2Q H2SQ (亚硫酸) 二氧化硫与碱的反应SQ + 2 NaQH = NaSQ + H2Q; SQ + NaQH = NaHSQSO2 + 2 NaOH = NaSQ + HHO; NSQ + HHO + SQ= 2NaHSO 向澄清石灰水中通入SO2,起初会看到沉淀,继续通入,沉淀消失。SQ + Ca(OH2)= C
2、aSOJ + HzO; SQ + Ca(OH) + 0 =Ca( HSQ) 2 S02 + Ca(QH) = CaSQJ + fO; CaSQ + H2Q + SQ =Ca (HSQ) 2 与碱性氧化物反应 SQ+CaQ=CaSQ(2) 二氧化硫的氧化性:SQ+2fS = 3S + 2fQ(3) 二氧化硫的还原性 与卤素单质反应:SQ + Br2 + 2fQ = fSQ + 2HBr SQ + C2 + 2f Q = fSQ + 2HCl 与某些强氧化剂的反应:2KMnQ4 + 2H2Q+ 5SQ = KSQ +2MnSQ +2H2SQ4惬化剂、 SQ的催化氧化2SQ+Q、顾、2SQ漂白性SQ能跟某些有色物质化合而生成不稳定的物质,该物质易分解恢复 为原有色物质。常见的漂白剂:漂白剂HClO.NiuOSO2活性炭原理具有强氧化性,将有色物质氧化成无色与某些有色物质 化合成不植定的无色物质吸附有色物质特点不可逆*褪色后颜邑不再壇原可逆.受热或放置一段时间可复原变优化学化学物理(5)用途:制 H2SQ4 ;作漂白剂;杀菌,消毒。(6) SO2 的实验室制法A.反应原理:NazSQ + HH
3、SO4= NaSQ +SQ f +巴0B制备装置:固体和液体不加热制备气体的装置。C净化干燥装置:盛放浓硫酸的洗气瓶。D. 收集方法:向上排空气法或排饱和 NaHSQ溶液。E. 检验:湿润的蓝色石蕊试纸-变红 湿润的品红试纸-褪色F尾气处理:用NaQH溶液和倒扣漏斗装置防倒吸。(7)SQ的污染酸雨:空气中SOX和NQx随雨水下降成为酸雨,pH5.6。(三) 三氧化硫1、物理性质:又名硫酸酐,是一种无色易挥发的晶体,溶沸点都很 低。2、化学性质:具有酸的氧化物的通性,与水反应放出大量的热,具 有较强的氧化性。(四) 硫化氢1、H2S的物理性质:无色、有臭鸡蛋气味的气体,密度比空气大,能溶于水,有剧毒。2、实验室制法: 由强酸制弱酸的原理:FeS + H2SQ4 = FeSQ4+ H2SfFeS + 2HCl = Fe2C+l H2SfFeS + 2H = Fe2+ H2Sf用湿润的Pb(CHCOO)试纸Pb(CHCOO) + H2S = PbS + 2CH3COOH 试纸变黑3、化学性质可燃性点燃点蟻2H2S + 3Q2H2 0+ 2SQ2fS + Q2出0 + S(2) 还原性:H2S
《硫和氮的氧化物知识总结汇编》由会员ni****g分享,可在线阅读,更多相关《硫和氮的氧化物知识总结汇编》请在金锄头文库上搜索。

电信网络股份有限公司商业计划书

养生会所策划方案

小学科学实验教学计划参考模板(2篇).doc

外科学习题集(总论)

高二年级德育工作计划

河北省唐山市滦南县八年级地理下学期期中试题扫描版新人教版0523152

冬雨季施工技术措施
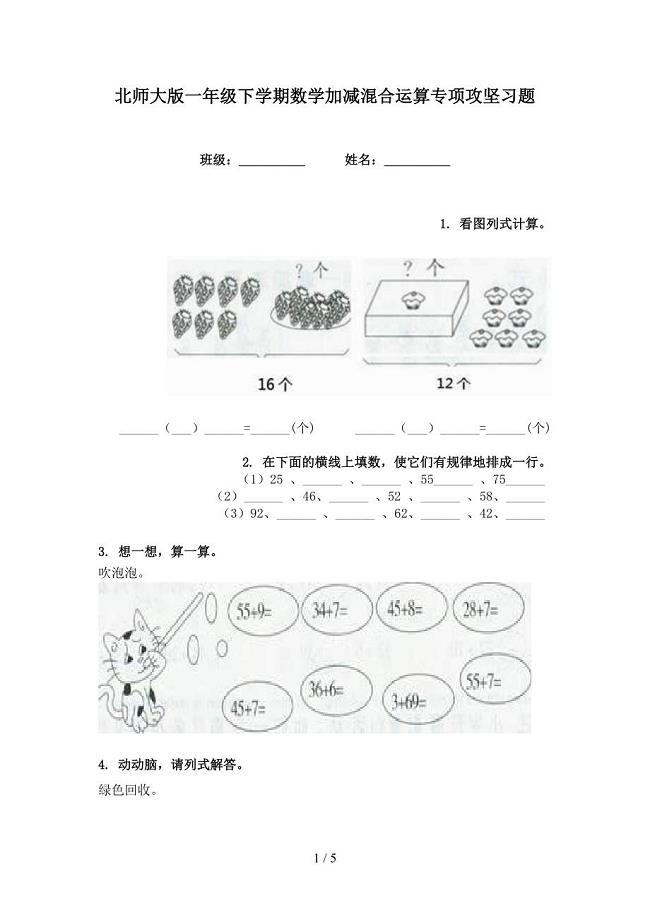
北师大版一年级下学期数学加减混合运算专项攻坚习题

小学三年级作文美丽的校园

交通安全心得体会400字3篇

化工专业实验

大一国家助学金申请书800字范文.doc

包装工厂个人实习总结范文(三篇).doc

2022年XX年保持共产党员先进性教育心得体会

东北大学21春《矿山地质II》在线作业一满分答案72

高中语文必修一《雨巷》教学设计

关于错时错峰上下学工作方案

川农21秋《园林工程本科》综合测试题库答案参考31

女生部工作总结3篇

三年级语文月考试卷
 2023年年幼儿园感恩节活动策划范本五篇
2023年年幼儿园感恩节活动策划范本五篇
2023-03-31 14页
 教师节工作总结归纳
教师节工作总结归纳
2022-08-02 6页
 高速公路房建工程施工组织设计
高速公路房建工程施工组织设计
2022-12-01 18页
 五一劳模演讲稿
五一劳模演讲稿
2022-07-26 2页
 2023年新实习劳动合同范本新,菁华1篇
2023年新实习劳动合同范本新,菁华1篇
2024-02-27 5页
 教师读书随笔爱是彼此的驯养——读小王子有感
教师读书随笔爱是彼此的驯养——读小王子有感
2022-10-08 16页
 防水材料购销合同
防水材料购销合同
2023-11-25 7页
 小学六年级心理健康教育教案xiug
小学六年级心理健康教育教案xiug
2023-01-18 17页
 采购管理表格厂商调查表
采购管理表格厂商调查表
2023-11-03 3页
 个人购房委托书
个人购房委托书
2023-01-15 4页

