
溶液中离子浓度大小比较总结归类(超全)
16页1、(完整)溶液中离子浓度大小比较总结归类(超全)(完整)溶液中离子浓度大小比较总结归类(超全)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对 文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(完整)溶液中离子浓度大小 比较总结归类(超全)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和 反馈,这将是我们进步的源泉,前进的动力。本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快 业绩进步,以 下为(完整)溶液中离子浓度大小比较总结归类(超全)的全部内容。一、电离平衡理论和水解平衡理论1. 电离理论:弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注 意考虑水的电离的存在;例如NHH0溶液中微粒浓度大小关系。32【分析】由于在NHH0溶液中存在下列电离平衡:NHH0 =NH+0H-, H 0 =H+OH-,323242所以溶液中微粒浓度关系为:c (NHH 0)c (OH-)c (NH+)c (H+)。324多元弱酸的电离是分步的,主要以第一步电离为主;例
2、如H2S溶液中微粒浓度大小关系。【分析】由于HS溶液中存在下列平衡:HS =HS-+H+, HS- =S2-+H+,H0 =H+OH-,所2 2 2以溶液中微粒浓度关系为:c(HS )c (H+)c(HS-)c (OH)。22. 水解理论:弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHC0溶液中有:c(Na+)c(HC0-).33弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及 产生H+的(或 0H)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性 溶液中c(H+)(或碱性溶液中的c (0H-)总是大于水解产生的弱电解质的浓度;例如(NH ) SO424 溶液中微粒浓度关系。【分析】因溶液中存在下列关系:(NH) SO =2NH +S0 2-,424442H 0;20H-+2H+,22NHH 0,由于水电离产生的c(H+) =c(0H)3 2水而水电离产生的一部分0H-与NH+结合产生NHH 0,另一部分0H-仍存在于溶液中,所以溶水432液中微粒浓度关系为:c (NH+)c (S0 2-)c(H+)c (NH H0 )c (0H)。
3、4432一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c (H+)c(0H-),水解呈 碱性的溶液中c(0H-)c(H+);多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。例如NaC0溶液中微粒23 浓度关系。【分析】因碳酸钠溶液水解平衡为:C0 2+H 0=HC0-+0H-, H 0+HC0 =H C0+0H-,所以溶3232323液中部分微粒浓度的关系为:c(C0 2-)c (HC0-)。33二、电荷守恒和物料守恒1电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷 数相等。如 NaHC0 溶液中:n (Na+)+n(H+)=n (HC0)+2n (C0 2)+n(0H)推出:c (Na+)333+c(H+)=c(HC0 )+2c(C0 2-)+c(0H-)332物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的如NaHC0溶液中n(Na+):(c) =1:1,推出:c (Na+)=c(HC0-)+c(C0 2)+c(HC0)3 3 2 3【注意】书写电荷守恒
4、式必须准确的判断溶液中离子的种类;弄清离子浓度和电荷浓度的关系。3导出式-质子守恒: 如碳酸钠溶液中由电荷守恒和物料守恒将Na+离子消掉可得:c (H-)=c(H+)+c(HC3-)+2c(H2C3)此关系式也可以按下列方法进行分析,由于指定溶液中氢原子的物质的量为定值,所以无论溶 液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等。可以用图示分析如下合1个疋结合2个ft十 HCOf h2co3失去1个才0H 结合1个疋H20,由得失氢离子守恒可得:c (OH-)二c(H+) +c (HCO -)+2c(H CO ).323又如醋酸钠溶液中由电荷守恒和物料守恒将钠离子消掉可得:c(OH)=c(H+)+c(CH COOH)。3【规律总结】1、必须有正确的思路:电解质溶液,单一溶液混合溶液J酸或碱落液一一考虑电离盐落液一一芳虑水解木反应一一同时考虑电离和水解_ J生成酸或确考虑电离 i生成盐考虑水解 根据过量程度考虑电离或水解不过量过量一2、掌握解此类题的三个思维基点:电离、水解和守恒3、分清他们的主要地位和次要地位常见题型】一、溶质单一型关
《溶液中离子浓度大小比较总结归类(超全)》由会员ni****g分享,可在线阅读,更多相关《溶液中离子浓度大小比较总结归类(超全)》请在金锄头文库上搜索。

国土资源局自查报告

一年级语文看菊花课件

实验幼儿园清明节放假通知及温馨提示

XXX大桥及南北引线工程试验检测计划书

新星物业管理公司程序文件

深圳大学授予博士学位工作细则(试行)

高中语文文言文常见固定词语翻译

学校防范非法集资宣传月活动总结

餐饮业pos销售管理系统管理信息系统课程设计23组MIS课程设计实验报告

精密螺丝刀项目商业计划书写作参考

初三一元二次方程练习题及答案

2022年高中历史第7课第一次工业革命精品教案必修2

三月的天娃娃的脸

欧姆龙NJ控制器在点胶机上的应用
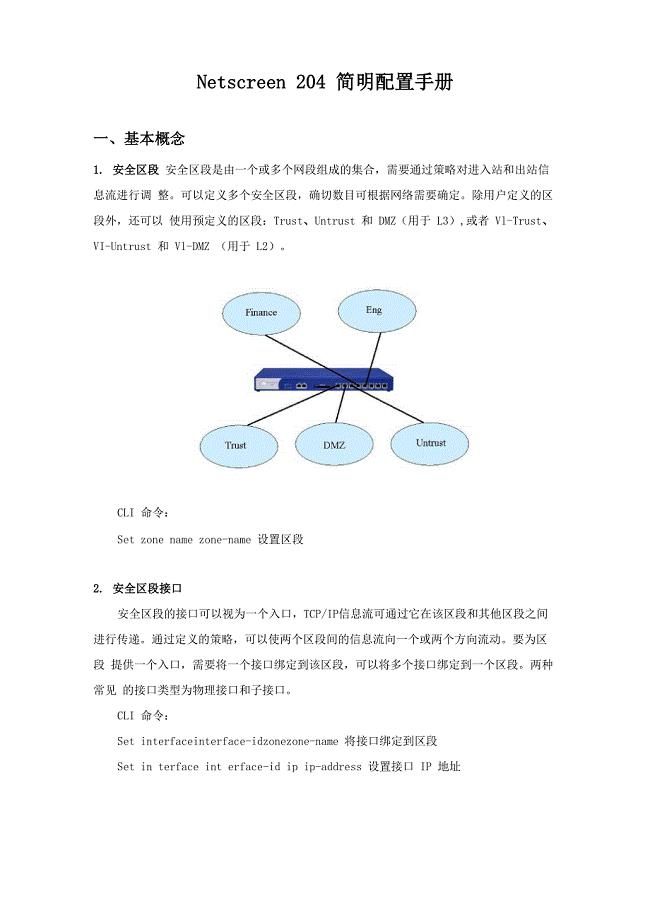
Netscreen 204 简明配置手册(以网管网为例)

图书馆环境卫生管理制度模板(4篇).doc

商业摄影合同(六篇).doc

人教版四年级下语文教案

九年级Unit5ItmustbelongtoCarla教案

公共基础知识主观题答题技巧与方法
 公务员法考试题库和答案
公务员法考试题库和答案
2023-02-01 40页
 劳动合同书(供以完成一定任务为期限的导游员
劳动合同书(供以完成一定任务为期限的导游员
2023-11-02 15页
 老阿姨观后感
老阿姨观后感
2023-03-01 2页
 加强社会管理创新工作方案
加强社会管理创新工作方案
2023-03-22 3页
 大学生活动方案(四篇)
大学生活动方案(四篇)
2023-06-17 9页
 公司供应部安全职责.docx
公司供应部安全职责.docx
2022-11-04 2页
 初等数论期末复习
初等数论期末复习
2023-05-21 7页
 健身客服工作总结
健身客服工作总结
2023-03-26 6页
 生物学如何培养学生的实验能力
生物学如何培养学生的实验能力
2023-12-01 4页
 如何带好一个销售团队
如何带好一个销售团队
2023-04-02 18页

