
高中化学必背基础知识高中化学必背知识点归纳和总结
10页1、高中化学必背基础知识高中化学必背知识点归纳和总结 一、俗名无机部分:纯碱、苏打、天然碱 、口碱:na2co3 小苏打:nahco3 大苏打:na2s2o3 石膏(生石膏): 熟石膏:2caso4.h2o 莹石:caf2 重晶石:baso4(无毒) 碳铵:nh4hco3 石灰石、大理石:caco3 生石灰:cao 食盐:nacl 熟石灰、消石灰:ca(oh)2 芒硝:na2so47h2o (缓泻剂) 烧碱、火碱、苛性钠:naoh 绿矾:faso47h2o 干冰:co2 明矾:kal (so4)212h2o 漂白粉:ca (clo)2 、cacl2(混和物) 泻盐:mgso47h2o 胆矾、蓝矾:cuso45h2o 双氧水:h2o2 皓矾:znso47h2o 硅石、石英:sio2 刚玉:al2o3 水玻璃、泡花碱、矿物胶:na2sio3 铁红、铁矿:fe2o3 磁铁矿:fe3o4 黄铁矿、硫铁矿:fes2 铜绿、孔雀石:cu2 (oh)2co3 菱铁矿:feco3 赤铜矿:cu2o 波尔多液:ca (oh)2和cuso4 石硫合剂:ca (oh)2和s 玻璃的关键成份:na2sio3、ca
2、sio3、sio2 过磷酸钙(关键成份):ca (h2po4)2和caso4 重过磷酸钙(关键成份):ca (h2po4)2 天然气、沼气、坑气(关键成份):ch4 水煤气:co和h2 硫酸亚铁铵(淡蓝绿色):fe (nh4)2 (so4)2 溶于水后呈淡绿色光化学烟雾:no2在光照下产生的一个有毒气体 王水:浓hno3:浓hcl按体积比1:3混合而成。铝热剂:al + fe2o3或其它氧化物。 尿素:co(nh2)2有机部分:氯仿:chcl3 电石:cac2 电石气:c2h2 (乙炔) tnt:三硝基甲苯氟氯烃:是良好的制冷剂,有毒,但破坏o3层。 酒精、乙醇:c2h5oh裂解气成份(石油裂化):烯烃、烷烃、炔烃、h2s、co2、co等。焦炉气成份(煤干馏):h2、ch4、乙烯、co等。 醋酸:冰醋酸、食醋 ch3cooh甘油、丙三醇 :c3h8o3 石炭酸:苯酚 蚁醛:甲醛 hcho福尔马林:35%40%的甲醛水溶液 蚁酸:甲酸 hcooh葡萄糖:c6h12o6 果糖:c6h12o6 蔗糖:c12h22o11 麦芽糖:c12h22o11 淀粉:(c6h10o5)n硬脂酸:c17h3
3、5cooh 油酸:c17h33cooh 软脂酸:c15h31cooh草酸:乙二酸 hooccooh (能使蓝墨水褪色,呈强酸性,受热分解成co2和水,使kmno4酸性溶液褪色)。二、 颜色铁:铁粉是黑色的;一整块的固体铁是银白色的。fe2+浅绿色 fe3o4黑色晶体 fe(oh)2白色沉淀fe3+黄色 fe (oh)3红褐色沉淀 fe (scn)3血红色溶液feo黑色的粉末 fe (nh4)2(so4)2淡蓝绿色fe2o3红棕色粉末铜:单质是紫红色cu2+蓝色 cuo黑色 cu2o红色cuso4(无水)白色 cuso45h2o蓝色cu2(oh)2co3 绿色cu(oh)2蓝色 cu(nh3)4so4深蓝色溶液fes黑色固体baso4 、baco3 、ag2co3 、caco3 、agcl 、 mg (oh)2 、三溴苯酚均是白色沉淀al(oh)3 白色絮状沉淀 h4sio4(原硅酸)白色胶状沉淀cl2、氯水黄绿色 f2淡黄绿色气体 br2深红棕色液体i2紫黑色固体 hf、hcl、hbr、hi均为无色气体,在空气中均形成白雾ccl4无色的液体,密度大于水,和水不互溶na2o2淡黄色固体
4、ag3po4黄色沉淀 s黄色固体 agbr浅黄色沉淀agi黄色沉淀 o3淡蓝色气体 so2无色,有剌激性气味、有毒的气体so3无色固体(沸点度) 品红溶液红色 氢氟酸:hf腐蚀玻璃n2o4、no无色气体 no2红棕色气体nh3无色、有剌激性气味气体 kmno4-紫色 mno4-紫色三、 现象:1、铝片和盐酸反应是放热的,ba(oh)2和nh4cl反应是吸热的;2、na和h2o(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、红)3、焰色反应:na 黄色、k紫色(透过蓝色的钴玻璃)、cu 绿色、ca砖红、na+(黄色)、k+(紫色)。4、cu丝在cl2中燃烧产生棕色的烟; 5、h2在cl2中燃烧是苍白色的火焰;6、na在cl2中燃烧产生大量的白烟; 7、p在cl2中燃烧产生大量的白色烟雾;8、so2通入品红溶液先褪色,加热后恢复原色;9、nh3和hcl相遇产生大量的白烟; 10、铝箔在氧气中剧烈燃烧产生刺眼的白光;11、镁条在空气中燃烧产生刺眼白光,在co2中燃烧生成白色粉末(mgo),产生黑烟;12、铁丝在cl2中燃烧,产生棕色的烟; 13、hf腐蚀玻璃:4hf +
《高中化学必背基础知识高中化学必背知识点归纳和总结》由会员re****.1分享,可在线阅读,更多相关《高中化学必背基础知识高中化学必背知识点归纳和总结》请在金锄头文库上搜索。

作业设计 (2)

2018届九年级英语全册Unit6Whenwasitinvented第5课时当堂达标题新版人教新目标版

会计学实习报告【三】
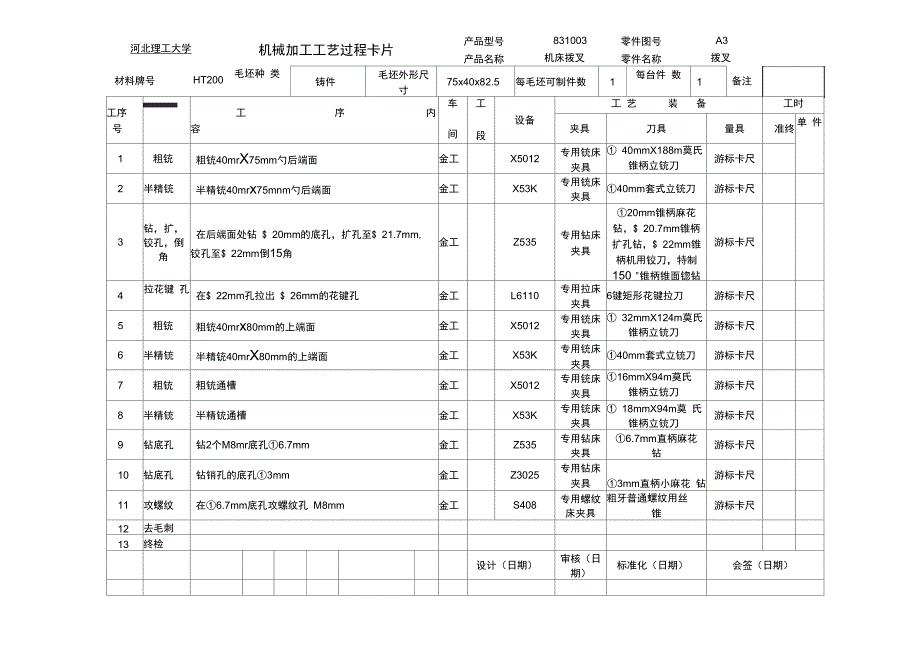
机械制造工艺学课程设计工艺过程卡

SAPBW配置及操作标准手册BW中文图文教程

利用物理课堂培养学生科学学习的素质

农民专业合作经济组织特征原则和作

《钢铁是怎样炼成的》名著资料

同学聚会方案2稿

水上交通宏观模拟软件需求规格说明

高一军训心得体会感想5篇

(完整版)小学奥数-比和比例(教师版)

挖机租赁合同协议书样本(6篇).doc

2022银行招聘考试(全能考点剖析)名师点拨卷含答案附答案92

2023三跳运动会加油稿

2010年1月18日七上期末复习讲义

人教版 高中数学 选修221.5.1曲边梯形的面积学案

信息安全考试 (2)

青岛版小学数学上册第一单元

柜台出租合同范文合集九篇
 企业预算及反应函数探究
企业预算及反应函数探究
2022-10-17 12页
 国内研究报告生培养创新知易行难
国内研究报告生培养创新知易行难
2023-09-06 4页
 Book6Module2导学案
Book6Module2导学案
2022-09-20 6页
 历年水利水电工程常考题
历年水利水电工程常考题
2023-11-19 16页
 柴油发电机组运行管理制度
柴油发电机组运行管理制度
2023-01-09 10页
 《城市规划原理》第四版第20章城市遗产保护与复兴归纳总结
《城市规划原理》第四版第20章城市遗产保护与复兴归纳总结
2023-06-01 3页
 解决四风问题调研报告
解决四风问题调研报告
2023-05-14 6页
 英语字母、身体部位教案
英语字母、身体部位教案
2023-12-09 2页
 中学管理经验交流材料_1
中学管理经验交流材料_1
2022-12-12 2页
 初一语文阶段性检测题
初一语文阶段性检测题
2022-08-03 6页

