
高中化学物质结构与性质专题强化训练
18页1、高三物质结构强化训练1.A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答问题:(1)写出E的基态原子的电子排布式_。(2)含有元素D的盐的焰色反应为 色,许多金属形成的盐都可以发生焰色反应,其因是 。(3)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为_,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为_。(4)G与C可形成化合物GC和G2C,已知GC在加热条件下易转化为G2C,试从原子结构的角度解释发生转化的原因 。(5)G与氮元素形成的某种化合物的晶胞结构如下图所示,则该化合物的化学式为_,氮原子的配位数为 。若晶体密度为a gcm-3,则G原子与氮原子最近的距离为_pm(写出数学表达式,阿伏加德罗常数的值用NA表示)。2.表是前20号元素中的部分元素的一些数据:ABCDEFGHIJ原子半径(
2、1010 m)1.022.270.741.430.771.100.991.860.751.17最高价态+6+1+3+4+5+7+1+5+4最低价态2243134试回答下列问题:(1)以上10种元素电负性最大的是 (填元素符号)比元素B原子序数大7的元素在元素周期表中的位置:第 周期,第 族,其基态原子的核外电子排布式是 (2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序) (3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子其分子中共形成个键,个键(4)I与氢元素形成的10电子分子X的空间构型为 ;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为 ,其中X与Cu2+之间以 键结合(5)如图1是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:a b (6)如图2是J和E组成的晶体结构,则每个与J周围最近J原子数目为 ,若晶胞边长为a cm,则晶体的密度为(用含a、NA的代数式表示) (g/mL)图1 图23.M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p 轨道电子数是s轨道电
3、子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。据此请回答下列问题:(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是。(3)X与M形成的XM3分子的空间构型是。(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是(填离子符号)。(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。4.配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。(1)写出元素D在周期表中的位置是 ,B原子的外围电子排布图 。E原子的核外有 种不同运动状态的电子,B和C的第一电离能大小关系。(用元素符号表示)(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,画出原子个数比
《高中化学物质结构与性质专题强化训练》由会员公****分享,可在线阅读,更多相关《高中化学物质结构与性质专题强化训练》请在金锄头文库上搜索。

古代诗词三首《早春呈水部张十八员外》《西江月》《秋词》教案2

会员评家工作总结

班组管理与班队活动

现代建筑钢结构工程安全教育与培训教材带光盘

2022年慈善活动实施方案

六年级年度数学组教学工作计划范本(7篇).doc

【可编辑】2023年学生会就职演讲稿

2022年房屋格式合同4

中考数学几何变换及试题汇编全套名师制作精品教学课件

高中体育教学反思

端午节放假平安训练班会总结

幼儿老师求职信9篇

《财富之源》导学案

建筑公司质量安全体系

团队精神演讲稿范文集锦7篇

中国家用电器行业生产指数分析报告

个人上半年工作总结标准版(2篇).doc

一级建造师项目管理考前(难点+易错点剖析)押密卷答案参考20

公共关系选择精选题
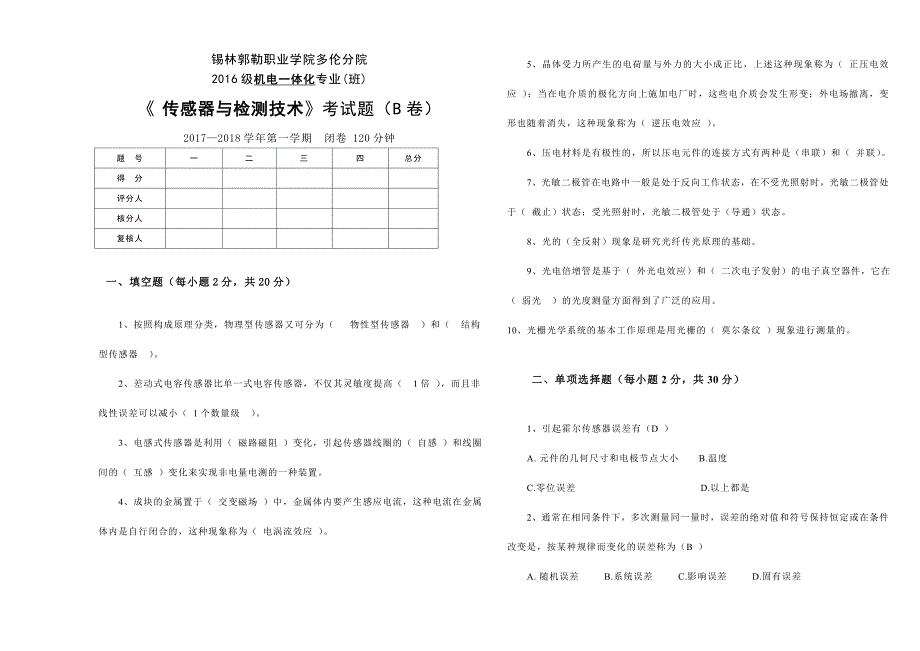
传感器与检测技术B卷及答案
 四川省成都市第七中学2019届高三政治10月阶段性测试试题(含解析)
四川省成都市第七中学2019届高三政治10月阶段性测试试题(含解析)
2023-11-24 12页
 小学语文教学工作总结大全
小学语文教学工作总结大全
2022-08-20 5页
 会计实务:“营改增”会计处理问题解答
会计实务:“营改增”会计处理问题解答
2023-06-23 2页
 姜子牙观后感
姜子牙观后感
2024-01-25 19页
 电大中级财务会计真题及答案三
电大中级财务会计真题及答案三
2023-07-20 5页
 公司并购的类型
公司并购的类型
2023-05-03 5页
 企业贺词
企业贺词
2023-02-13 7页
 开学周记模板合集七篇
开学周记模板合集七篇
2023-07-09 10页
 月光启蒙(第二课时及作业) (2)
月光启蒙(第二课时及作业) (2)
2023-10-03 7页
 中班亲子游戏好玩的纸箱
中班亲子游戏好玩的纸箱
2022-10-20 2页

