
比较溶液中粒子浓度大小专题指导(精品)
5页1、溶液中粒子浓度大小的比较陈 永 电解质溶液中粒子浓度大小比较问题是高考的热点之一。这类问题由于涉及的知识点多,能有效地检测考生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握情况及对这些知识的综合运用能力;试题综合性较强、题型灵活性、区分度高,因而重现率极高。因此,有必要对学生进行系统的知识归纳并进行解法指导,以利于提高学生的综合能力。本文就从“两个平衡、三个守恒”两个方面进行详细绍。一、两个平衡 两个平衡即弱解质的电离平衡和盐类的水解平衡。应用这两个平衡时一定要明确:弱电解质电离及盐类水解的程度一般很小,所以,对应产生的粒子浓度一般也都很小。如例1、常温下,比较0.1mol/L CH3COOH溶液中各主要粒子浓度大小。解题思路1.弄清原理:写出该溶液中所有离子方程式:CH3COOHCH3COO-+H+,H2OOH-+H+2.分清主次:判断上述过程中产生的离子浓度大小。因CH3COOH电离程度很小,因而溶液中的主要粒子为CH3COOH分子。虽然CH3COOH是弱电解质,电离程度小,但相比于极弱的电解质水来说,CH3COOH电离产生的离子比水分子电离产生的离子仍
2、要大很多。综合以上分析可以得出:c(CH3COOH) c(H+) c(CH3COO-) c(OH-)例2、常温下,比较0.1mol/L CH3COONa溶液中各主要粒子浓度大小。解题思路1.弄清原理:写出该溶液中所有离子方程式:CH3COONa= CH3COO- + Na+ , 度CH3COO- +H2O CH3COOH + OH-,H2OOH-+H+2.分清主次:判断上述过程中产生的粒子浓度大小。因CH3COONa是强电解质,完全电离,所以溶液中的主要粒子是CH3COO-和Na+,但CH3COO-因水解而使得c(Na+) c(CH3COO-)。虽然CH3COONa的水解程度很小,但过程仍比过程产生的粒子浓度大很多,即c(OH-) c(CH3COOH)c(H+),一般只要比较出:c(Na+) c(CH3COO-)c(OH-)c(H+)即可。小结:弱电解质电离及盐类水解产生的粒子浓度一般都很小,可概括为:谁的溶液谁(的粒子)主要。二、三个守恒关系:即电荷守恒、物料守恒及质子守恒。、电荷守恒:电解质溶液中所有阳离子所带的正电荷数与所有的阴离子所带的负电荷数相等。如例3.在常温下,写出Na2
3、CO3溶液中的电荷守恒式。解题思路1.弄清原理:写出该溶液中所有离子方程式:Na2CO3 =CO32-+2Na+ ,CO32-+ H2O OH-+HCO3-,HCO3-+H2OH2CO3+ OH-,H2OOH-+H+2.弄清数量关系:所有阳离子所带的正电荷数 = 所有的阴离子所带的负电荷数。阳离子所带的正电荷数为:n(Na+)+n(H+),阴离子所带的负电荷数为:n(HCO3-)+2n(CO32-)+n(OH-),所以有n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)。进而可以推出:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)。电荷守恒式特点:等式两端的粒子全都带电荷,一端带正电荷,另一端带负电荷(书写时要找全离子种类)用各粒子的浓度(或物质的量)各自所带的电荷数、物料守恒:由于弱电解质电离或盐类水解的原因,造成溶液中离子种类及数目会发生变化,但溶液中某两种元素的原子总数是不会改变的。如例4.在常温下,写出Na2CO3溶液中的物料守恒式。解题思路1.弄清原理:原理同例3 。2.弄清数量关系Na2CO3溶液中钠元素与碳元素的原子
4、个数比为21,即n(Na+)=2n(C)总。而碳原子总数n(C)总= n(HCO3-)+n(CO32-)+n(H2CO3)因可以得出:n(Na+)=2n(HCO3-)+2n(CO32-)+2n(H2CO3),进而可以推出:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) 物料守恒式特点:等式两端分别含有某两种元素的粒子(如钠与碳元素,一般不找与氢元素或氧元素的关系)通过化学组成可确定二者的比例关系。、质子守恒: 电解质溶液中分子或离子得到与失去的质子(H+)的物质的量相等。如例5. 写出NaHCO3溶液中的质子守恒式。解题思路 1.弄清原理:写出该溶液中所有离子方程式:NaHCO3=Na+HCO3,HCO3-+HOH2CO3+OH-, HCO3-CO32-+H+ ,H2OOH-+H+2.弄清数量关系: 得到的质子(H+)数 = 失去的质子(H+)数。在NaHCO3溶液中H3O+、H2CO3为得到质子后的产物;OH-、CO32-为失去质子后的产物。得到的质子数目为:n(H3O+)+n(H2CO3),失去的质子数目为:n(OH-)+n(CO32-),故有以下关系:n
《比较溶液中粒子浓度大小专题指导(精品)》由会员博****1分享,可在线阅读,更多相关《比较溶液中粒子浓度大小专题指导(精品)》请在金锄头文库上搜索。
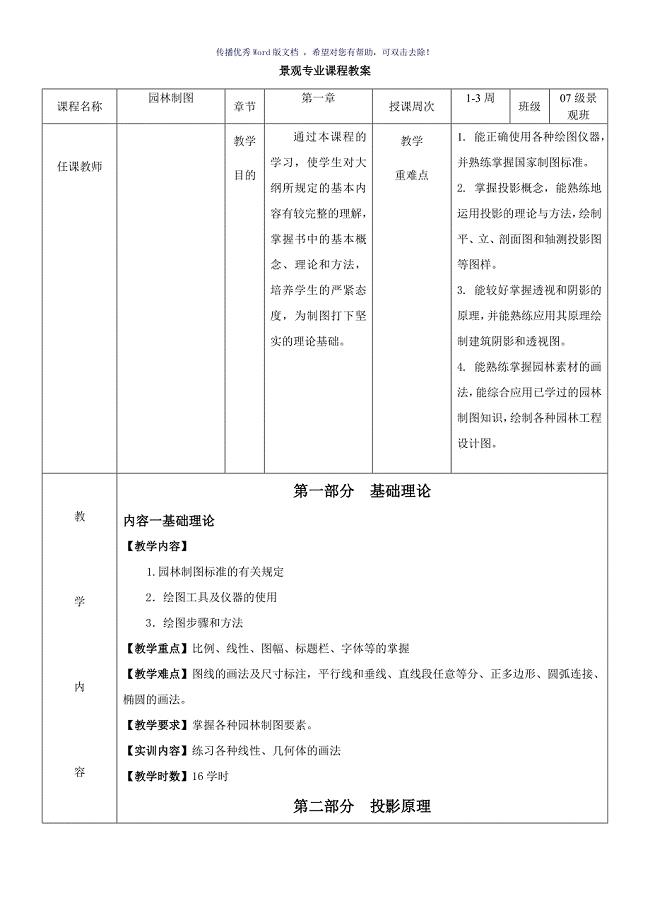
园林制图教案Word版

关于清明节国旗下演讲稿三篇

《消化性溃疡习题》word版

小公司规章制度范文

中国石油大学华东21秋《输气管道设计与管理》平时作业2-001答案参考78

南开大学21秋《电子商务网页制作》在线作业三满分答案96

历史精神和宪法:严复《政治讲义》论析

品质观念及品质意识训练1

小王子阅读心得字

政府采购供应商投诉书

华夏会计网继续教育考试题

初一母爱作文锦集五篇

堤防工程投标书施工组织设计方案

南开大学21秋《国际经济学》在线作业二满分答案67

房屋建筑监理规划示范本

高中语文教学反思

医疗收费管理制度

鞍山硅片销售项目申请报告(模板范本)

二年级上语文复习备课

一位陌生的哥哥
 高三化学第一轮复习总结资料
高三化学第一轮复习总结资料
2023-11-21 18页
 人教版数学八年级下册《正比例函数》提升练习题
人教版数学八年级下册《正比例函数》提升练习题
2023-09-01 4页
 TJ 03标人工孔桩爆破施工方案 7 17定稿
TJ 03标人工孔桩爆破施工方案 7 17定稿
2023-04-16 13页
 市场营销论文:—品牌营销
市场营销论文:—品牌营销
2023-01-17 18页
 身体素质的生理学基础
身体素质的生理学基础
2023-06-14 36页
 九年级化学下册8.2.2溶解度曲线同步精品测案基础版含解析
九年级化学下册8.2.2溶解度曲线同步精品测案基础版含解析
2022-08-19 8页
 政府采购供应商投诉书
政府采购供应商投诉书
2023-09-30 3页
 八年级期末复习专题《作图题》(32)(精品)
八年级期末复习专题《作图题》(32)(精品)
2023-02-12 3页
 中职职业生涯规划教案
中职职业生涯规划教案
2023-11-23 21页
](/Images/s.gif) XX安全施工组织设计[1](DOC 38页)
XX安全施工组织设计[1](DOC 38页)
2022-08-27 38页

