
2016年1010药品数据管理规范(征求意见稿)
8页1、 .wd.药品数据管理标准征求意见稿第一章 总则第一条【目的】为标准药品生命周期中相关数据的管理,保证药品质量和患者用药安全有效,依据?中华人民共和国药品管理法?和?中华人民共和国药品管理法实施条例?,制定本标准。第二条【范围】本标准适用于药品研制、生产、流通等活动,包括从事上述活动的临床试验、合同研究CRO、委托生产CMO、委托检验等单位和个人。第三条【原那么】数据管理应贯穿整个数据生命周期,坚持真实、准确、及时、可追溯的数据管理原那么,确保数据可靠性DataIntegrity。第四条【诚信原那么】执行本标准应当坚持老实守信,制止任何虚假行为。第二章质量管理第一节原那么第五条【质量体系】数据管理作为药品质量管理体系的一局部,应当具有相应的管理规程,确保数据可靠性。第六条【不安全因素管理】质量不安全因素管理是数据管理的重要工具和技术手段,应当贯穿整个数据生命周期。第七条【质量文化】高层管理者应当重视数据可靠性,倡导公开、透明的质量文化,鼓励员工遇到数据可靠性问题时及时报告和沟通。第二节 质量管理体系第八条【 基本要求】应建设恰当的组织构造和规程,监测和预防可能影响数据可靠性的不安全因素
2、。第九条【问题调查】违反数据可靠性要求的事件应当依照批准的偏差处理程序进展调查,找出 基本原因,实施纠正预防措施。当调查发现对申报资料可靠性、产品质量、使用者安全有直接影响的,应当报告药监部门。第十条【质量审计】数据可靠性的执行情况应当作为自检和定期审核的一局部,并经高层管理人员审核。第十一条【委托管理】数据可靠性的要求应列入委托和采购活动的质量协议或书面合同,明确双方职责,委托方对数据可靠性及基于数据作出的决定负最终责任,并定期审核受托方数据可靠性执行情况。第十二条【持续改进】应当确保数据可靠性的执行在数据生命周期中始终处于适当的持续监控。鼓励采用先进技术控制数据可靠性不安全因素,促进数据管理的持续改进,促进知识管理和产品质量的持续提升。第十三条【质量不安全因素管理】应当基于GXP活动、技术和流程的数据可靠性可能存在的不安全因素,采用适宜的不安全因素管理工具和管理策略,确保数据生命周期内数据可靠性的不安全因素得到有效管理。第三章人员第十四条【高层管理者】企业高层管理者应负责建设良好的企业质量文化,配置充分的人力和技术资源,以确保质量体系满足产品生命周期数据可靠性的客观要求,对组织内药
3、品数据可靠性负有最终责任。第十五条【管理层责任】各级管理层人员应建设和维护以数据可靠性为要素的质量管理体系和相关管理规程;确保员工与数据可靠性相关的工作质量不受商业、政治、财务和其它组织压力或动因的影响;积极参与和推进在工艺、方法、环境、人员、技术等方面的降低数据可靠性不安全因素的活动。第十六条【所有员工】所有员工须遵守数据管理标准的要求及公司内部相关管理规定,有责任报告数据可靠性的任何问题,以免影响成品质量和患者用药安全。第十七条【培训】所有涉及GXP数据相关工作人员应完成数据可靠性的培训。第四章数据管理第一节原那么第十八条【数据生命周期】数据管理应贯穿其整个生命周期,包括数据的生成或创立、采集、记录、处理、审核、报告、存储、备份、销毁等过程。第十九条【数据类型】数据可由以下几种情况产生:一人工观测后填写在纸质记录中的数据。二仪器、设备或计算机化系统产生的数据。三采用摄影、摄像技术获取的客观数据。四由原始数据衍生或取得的信息。第二节 数据归属至人第二十条【可归属性】通过记录中的签名可追溯至数据的创立者或修改者。修改已输入的关键数据应当经过批准,并记录修改理由。第二十一条【签名唯一】计
4、算机化系统中不同用户之间不得共享登陆账号或者使用通用登陆账号。假设计算机化系统不具备充分的技术控制能力,应当建设相应程序,可以采用纸质记录或混合模式的记录对电子记录签名,确保记录中操作行为归属到特定个人。第二十二条【电子签名】电子签名与纸质签名等效, 并应经过验证,不得使用个人手写签名的电子图片代替电子签名。第二十三条【特例】应有文件规定仅在某些特殊情况例如:记录行为本身对产品或工作造成不安全因素,如:在无菌操作区操作人员记录造成的生产线干预下,可由另一记录人员代替操作人员进展记录的程序、适用范围,相关操作人员和代记录人员。记录应当与操作同时进展,实际操作人员应当及时对记录进展确认签字。第三节 数据清晰可溯第二十四条【清晰】在药品生命周期中相关法规规定的保存期限内的任何时候,数据应清晰、可溯、可读、可被理解,应能确保可清晰地重现步骤或事件发生的顺序。第二十五条【审计追踪】当使用计算机化系统创立电子数据时,所有的数据创立或更改行为都应当通过计算机系统中的审计追踪,或由其他符合要求的元数据字段或系统其它功能来记录,确保其追溯性。当现存计算机化系统缺乏审计追踪功能时,可以使用替代方法,比方日
《2016年1010药品数据管理规范(征求意见稿)》由会员re****.1分享,可在线阅读,更多相关《2016年1010药品数据管理规范(征求意见稿)》请在金锄头文库上搜索。
![[精编]市场推广工作计划书范文 (2)](https://union.152files.goldhoe.com/2022-7/31/f525d710-138d-4ab4-b193-e4efb3c1d838/pic1.jpg)
[精编]市场推广工作计划书范文 (2)

(酒店产管理资料)国际酒店管理培训课程

如何做好学生管理及课堂管理

励志的演讲稿范文集合8篇

赛前准备工作

农业结构调整方案

销售经理个人年度总结汇报_总结汇报

七年级英语下册基础训练Unit7Itsraining作业新版

牛顿第一定律 (2)

半岛花园二期住宅工程监理实施细则

XX在综治信访维稳会议上的个人讲话稿()

学会自我保护讲话稿

超前小导管锚杆施工技术方案
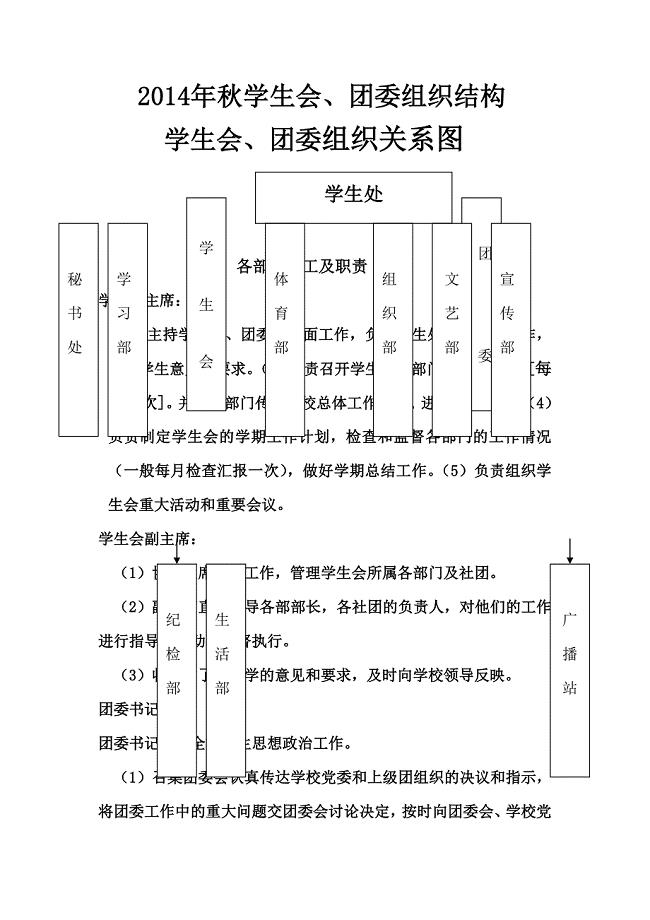
学生会组成和各部部长职责

中节开展做月饼活动总结(7篇)

音乐教师个人述职报告总结(4篇).doc

幼儿园庆六一文艺汇演活动总结(2篇).doc

2021年07月河北省邯郸市峰峰矿区政府系统2021年事业单位公开招考274名人员冲刺题(答案解析)

时代天朗花园节能方案

幼儿园大班安全教育计划
 小鹿斑比读后感(共五篇)
小鹿斑比读后感(共五篇)
2022-09-05 7页
 我是演说家励志演讲稿七篇
我是演说家励志演讲稿七篇
2023-02-10 22页
 软件工程师辞职申请
软件工程师辞职申请
2023-10-14 6页
 六年级上册词语盘点1-8单元看拼音写汉字
六年级上册词语盘点1-8单元看拼音写汉字
2023-01-24 9页
 大班主题我们的祖国真大教案反思
大班主题我们的祖国真大教案反思
2023-03-23 4页
 个人年度总结付林
个人年度总结付林
2023-07-08 7页
 龅牙兔儿童情商乐园市场调查问卷
龅牙兔儿童情商乐园市场调查问卷
2024-01-25 2页
 孝敬父母尊敬师长演讲稿
孝敬父母尊敬师长演讲稿
2024-01-15 5页
 解读幼儿园园长也需要的领导魅力
解读幼儿园园长也需要的领导魅力
2023-07-25 4页
 旅行社销售实习报告
旅行社销售实习报告
2022-09-12 15页

