
有关阿伏加德罗常数的常见错误类型举例
16页1、 有关阿伏加德罗常数的常见错误类型举例(1) 整体与部分的关系命题角度举例判断正误注意事项a. 求粒子数1 L 0.1 molL-1 K2CO3溶液中含有K+数目为0.1NA要注意溶质中和溶剂中都含有的微粒;要注意是离子还是官能团1 L 0.1 molL-1 H2O2溶液中含有O原子数为0.2NA1 mol Na2O2中含有的阴离子数为2NA1 mol OH中含有的电子数为10NA1 mol OH-中含有的电子数为10NA1 mol熔融的KHSO4中含有2NA个阳离子b. 求化学键数目0.1 mol CaC2中含碳碳三键数为0.2NA1 mol Na2O2、CaC2中含 、分别是1 mol;苯环中的碳碳键是介于单键和双键之间的一种独特的键,不含有碳碳双键;1 mol白磷(P4)含6 mol PP键;1 mol S8含8 mol SS键;1 mol金刚石(硅)含2 mol CC(SiSi)键;1 mol SiO2含4 mol SiO键1 mol苯中含有的碳碳双键数为3NA0.1 mol CCl4中含有的共价键数为0.4NA1 mol白磷中含有的PP键的数目为4NA1 mol甲烷中含有的C
2、H键的数目为4NA1 mol金刚石中含有的碳碳单键数为4NA氢原子数为0.4NA的甲醇分子中含有的键数为0.4NA1 mol二氧化硅中含有的SiO键为2NA(2) 已知物质的质量(或物质的量)求微粒个数命题角度举例判断正误注意事项a. 纯净物18 g H2O含有的分子数为NA单一纯净物直接计算因同位素而造成的摩尔质量不同的物质(如H2O、D2O组成的物质)分别计算2 g H2含有的原子数为2NA18 g H2O、D2O组成的物质中含有的质子数为10NAb. 混合物28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA对实验式相同的混合物,按最简式来计算(如乙烯和丙烯、乙烯和环丁烷,它们的最简式都是CH2)实验式不同的物质要分别计算注意整体和部分的关系常温常压下,92 g NO2和N2O4的混合气体中含有的原子数为6NA16 g O2和O3的混合气体中含有的O原子数为NA1 mol Na2O2和Na2S的混合物中含有的离子总数为3NA1 mol CO2和SO2的混合气体中含有的氧原子数为2NA(3) 电子转移数的计算举例判断正误注意事项过氧化钠与水反应时,生成0.1 mol氧
3、气转移的电子数为0.4NA要注意特殊物质,如由过氧化钠、过氧化氢制取1 mol氧气转移2 mol电子;铁与硫、碘、非氧化性酸反应,1 mol铁转移2 mol电子;1 mol铁与足量的氯气、稀硝酸反应,转移3 mol电子铁与硫的反应中,1 mol铁失去的电子数为3NA1 mol氯气与足量的水反应,转移的电子数为NA标准状况下,6.72 L NO2溶于足量的水中,转移的电子数为0.3NA3 mol铁在足量的氧气中燃烧,转移电子数为9NA1 mol铁在1 mol氯气中燃烧,转移的电子数为3NAKIO3+6HIKI+3H2O+3I2中,生成1 mol I2转移电子的总数为2NA(4) 常考陷阱命题角度举例判断正误注意事项a. 溶液体积未知在pH=13的NaOH溶液中OH-的数目为0.16.021023溶液的体积未知,溶质的物质的量无法计算,所含微粒数也无法计算0.1 molL-1NaF溶液中所含F-的数目小于0.1NA0.1 molL-1CH3COOH溶液中所含H+的数目为0.1NA0.1 molL-1FeCl3溶液中所含Fe3+的数目小于0.1NAb. 标准状况下与非标准状况下的陷阱常温常压
《有关阿伏加德罗常数的常见错误类型举例》由会员cl****1分享,可在线阅读,更多相关《有关阿伏加德罗常数的常见错误类型举例》请在金锄头文库上搜索。

入职培训心得体会1500字

第四代PC仿石材砖改建项目建议书写作模板-代写定制

初中语文 文摘(人生)捡垃圾的魅影侠(共2页DOC)

2023年广东省江门市新会区崖门镇梁黄屋村社区工作人员考试模拟题及答案

平陆县发挥“六大作用”,提升创建实效
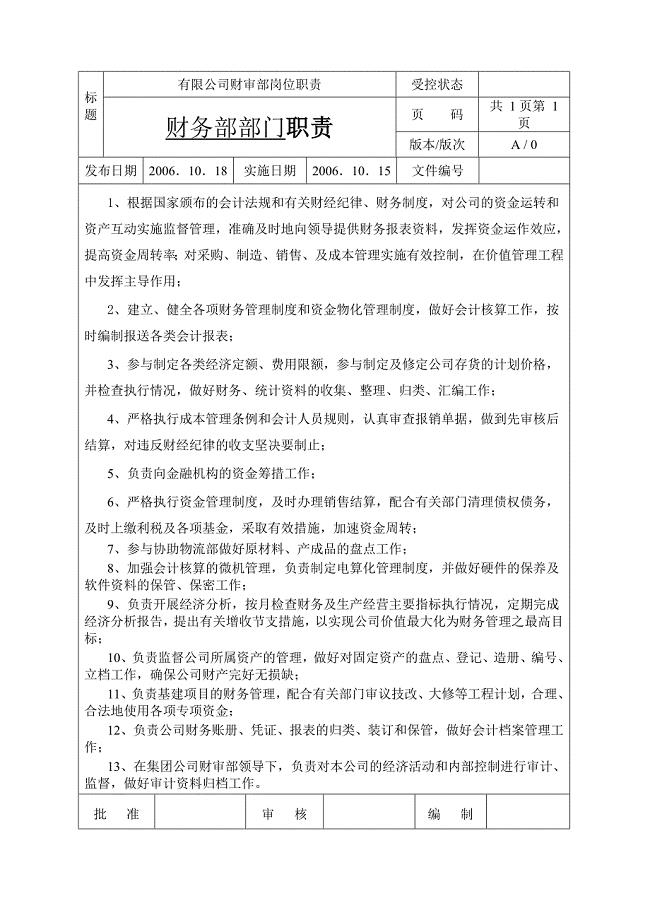
财务部部门及岗位职责

保卫部长竞聘演讲稿模板(3篇)

《鲁宾逊漂流记》读后感

幼儿园感恩节系列活动总结(二篇).doc

高二下学期文科试卷2

2022机械员-机械员专业管理实务考试全真模拟卷39(附答案带详解)

仁爱版英语九年级上Unit2Topic1SectionC教案高广英

2022年中式面点师(中级)资格考试模拟试题带答案参考31

-第二学期趣味篮球赛活动总结

个人职业规划3篇

某某年月音乐手机市场价格走势调查报告

试夯方案

最新窃读记教学设计 汇编

2023酒店服务员个人总结(3篇).doc
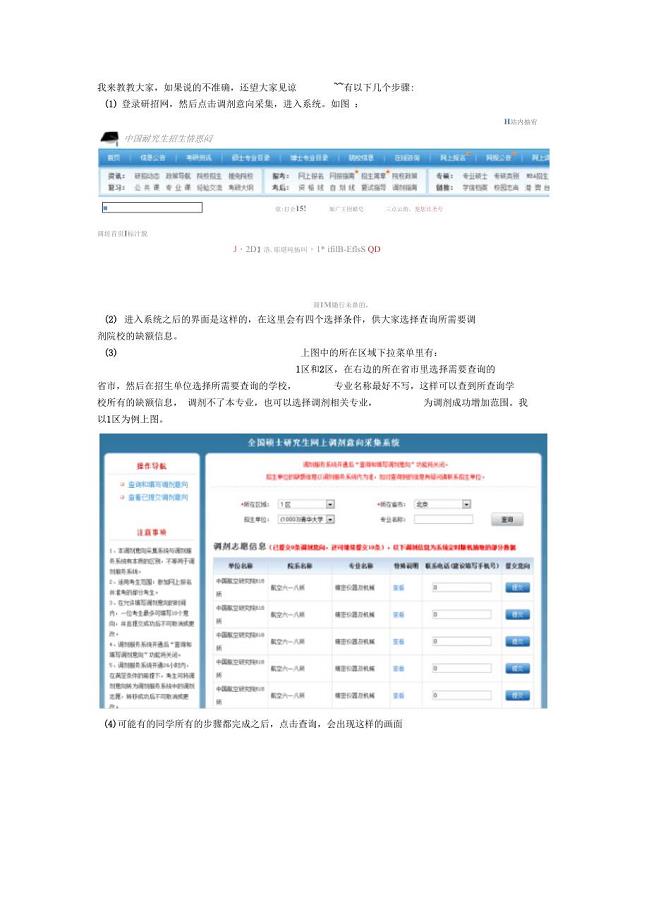
研招网调剂意向采集系统这样用
 三角形内角和180°证明7种方法
三角形内角和180°证明7种方法
2023-07-31 3页
 商品房买卖合同
商品房买卖合同
2022-09-08 3页
 低段趣味研究识字教学结题报告
低段趣味研究识字教学结题报告
2022-12-27 1页
 7年级(上)期中测试试题(完成)
7年级(上)期中测试试题(完成)
2023-08-01 4页
 课堂观察反思
课堂观察反思
2023-09-15 3页
 江苏鼋头渚的导游词
江苏鼋头渚的导游词
2024-02-05 7页
 设备部工作总结
设备部工作总结
2022-11-30 16页
 初中中考化学复习资料
初中中考化学复习资料
2024-02-19 8页
 笑着做教师感悟
笑着做教师感悟
2023-05-06 2页
 土方工程协承包议书
土方工程协承包议书
2022-12-07 2页

