
新版高中化学选修3 物质结构与性质 全册教学案人教版
79页1、 第 1 页 高中化学选修高中化学选修 3 3 物质结构与性质物质结构与性质 全部教学案全部教学案 人教版人教版 第 2 页 第一章第一章 原子结构与性质原子结构与性质 教材分析: 一、本章教学目标 1了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排 布式表示常见元素(136 号)原子核外电子的排布。 2了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件 下会发生跃迁产生原子光谱。 3了解原子核外电子的运动状态,知道电子云和原子轨道。 4认识原子结构与元素周期系的关系,了解元素周期系的应用价值。 5能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某 些性质。 6从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽 象思维、理论分析的过程中逐步形成科学的价值观。 本章知识分析: 本章是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构, 从构造原理和能量最低原理介绍了原子的核外电子排布以及原子光谱等,并图 文并茂地描述了电子云和原子轨道;在原子结构知识的基础上,介绍了元素周 期系、元素周期表及元素周期律。总之,本章按照课程标准要求比
2、较系统而深 入地介绍了原子结构与元素的性质,为后续章节内容的学习奠定基础。尽管本 章内容比较抽象,是学习难点,但作为本书的第一章,教科书从内容和形式上 都比较注意激发和保持学生的学习兴趣,重视培养学生的科学素养,有利于增 强学生学习化学的兴趣。 通过本章的学习,学生能够比较系统地掌握原子结构的知识,在原子水平 上认识物质构成的规律,并能运用原子结构知识解释一些化学现象。 注意本章不能挖得很深,属于略微展开。 相关知识回顾(必修相关知识回顾(必修 2 2) 1. 原子序数:含义: (1) 原子序数与构成原子的粒子间的关系: 原子序数 。 (3)原子组成的表示方法 a. 原子符号: AzX A z b. 原子结构示意图: c.电子式: d.符号 表示的意义: A B C D E (4)特殊结构微粒汇总: 无电子微粒 无中子微粒 第 3 页 2e-微粒 8e-微粒 10e-微粒 18e-微粒 2. 元素周期表:(1)编排原则:把电子层数相同的元素,按原子序数递增的 顺序从左到右排成横行叫周期;再把不同横行中最外层电子数相同的元素, 按电子层数递增的顺序有上到下排成纵行,叫族。 (2)结构:
3、各周期元素的种数 0 族元素的原子序数 第一周期 2 2 第二周期 8 10 第三周期 8 18 第四周期 18 36 第五周期 18 54 第六周期 32 86 不完全周期 第七周期 26 118 族 族序数 罗马数字 用表示;主族用 A 表示;副族用 B 表示。 主族 7 个 副族 7 个 第 VIII 族是第 8、9、10 纵行 零族是第 18 纵行 阿拉伯数字:1 2 3 4 5 6 7 8 罗马数字: I II III IV V VI VII VIII (3)元素周期表与原子结构的关系: 周期序数 电子层数 主族序数 原子最外层电子数元素最高正化 合价数 (4)元素族的别称:第A 族:碱金属 第IA 族:碱土金属第A 族:卤 族元素 第 0 族:稀有气体元素 3、有关概念: (1) 质量数: (2) 质量数( ) ( ) ( ) (3) 元素:具有相同 的 原子的总称。 (4) 核素:具有一定数目的 和一定数目 的 原子。 (5) 同位素: 相同而 不同的同一元素的 原子,互 短周短周 期期 周期周期 (共(共七七个)个) 短周短周 期期 族族 (共(共 个)个) 第 4 页
4、 称同位素。 (6) 同位素的性质:同位素的化学性质几乎完全相同 在天然存在的某种 元素里, 无论是游离态还是化合态,各种元素所占的百分比是不变的。 (7) 元素的相对原子质量: a、某种核素的相对原子质量 b、元素的相对原子质量 练习:用 A 质子数 B 中子数 C 核外电子数 D 最外层电子数 E 电子层数填下列空 格。 原子种类由 决定 元素种类由 决定 元素有无同位素由 决定 同位素相对原子质量由 决定 元素原子半径由 决定 元素的化合价由 决 定 元素的化学性质由 决定 4、元素周期律: (1) 原子核外电子的排布:电子层 。 分别用 n 或 来表示从内到外的电子层。 (2)排布原理:核外电子一般总是尽先从 排起,当一层 充满后再填充 。 5、判断元素金属性或非金属性的强弱的依据 金属性强弱非金属性强弱 1、最高价氧化物对应水化物碱 性强弱 最高价氧化物对应水化物酸性强弱 2、与水或酸反应,置换出 H 的 易难 与 H2化合的难易及气态氢化物的稳 定性 3、活泼金属能从盐溶液中置换 出不活泼金属 活泼非金属单质能置换出较不活泼非 金属单质 6、比较微粒半径的大小 (1)核电荷
《新版高中化学选修3 物质结构与性质 全册教学案人教版》由会员实***分享,可在线阅读,更多相关《新版高中化学选修3 物质结构与性质 全册教学案人教版》请在金锄头文库上搜索。

关于工会改革的几点思考考察心得

小学语文1~6年级阅读理解答题技巧北师大名师总结 新版

冀教版小学数学五年级上册同步练习新版

冀教版小学数学五年级上册教材习题参考答案新版

统编版三年级语文上册期末分类复习 基础+提高 适用于巩固提高

全网最全最新版链工宝2022年全国安全生产月知识竞赛题库及答案
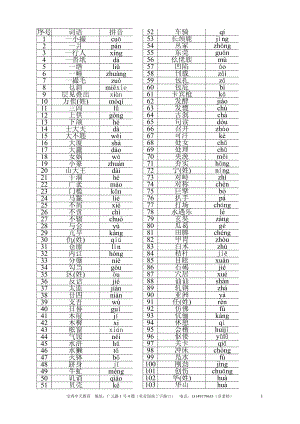
高考总复习 高考语文易错字音1000例
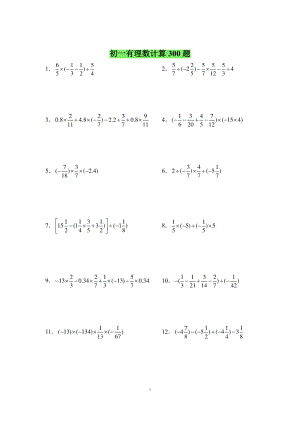
初中一年级书计算精选300题

普通话等级考试朗读范文含注音普通话考试朗读作品60篇 内含拼音与文字(1)

对国企领域违纪违法典型案例的剖析

冀教版小学数学五年级上册同步练习

冀教版小学数学四年级上册同步练习

冀教版小学数学六年级上册教材习题参考答案新版

冀教版小学数学四年级上册教材习题参考答案新版

冀教版小学数学四年级上册同步练习新版

部编教材1-6年级语文必背古诗文118篇新版

普通话等级考试朗读范文含注音普通话考试朗读作品60篇 内含拼音与文字

2023年全国普通话等级考试(规则、练习材料、试题)全国通用大纲教材精华版+必考题整理+

普通话等级考试朗读范文含注音普通话考试朗读作品60篇 内含拼音与文字

国家普通话水平考试培训教程2022新版
 新技术教育培训档案
新技术教育培训档案
2022-11-29 3页
 最新江苏省下半年土地估价师复习:土地管理概述考试题资料
最新江苏省下半年土地估价师复习:土地管理概述考试题资料
2023-02-26 10页
 民办学校财务管理办法
民办学校财务管理办法
2023-09-22 4页
 小区车辆进出停放管理制度
小区车辆进出停放管理制度
2022-11-11 1页
 高级汽车维修技师简答题及答案
高级汽车维修技师简答题及答案
2023-02-23 15页
 小区大门保安职务说明书(7)
小区大门保安职务说明书(7)
2023-06-25 2页
 不安全行为辨识表
不安全行为辨识表
2023-10-15 4页
 关于请示格式
关于请示格式
2023-10-08 3页
 【方案】安全生产竞赛活动方案
【方案】安全生产竞赛活动方案
2023-02-12 5页
 XX科技大厦室内装潢工程
XX科技大厦室内装潢工程
2023-09-29 28页

