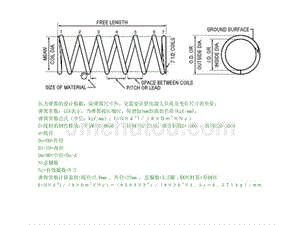
chemistry 酸碱理论
35页1、ChemistryChemistry 酸碱理论酸碱理论酸碱理论(来自 化学小朋友) tantan62 0| 消息(2) | 我的 i 贴吧| 我的俱乐部| 我的空间| 我的应用| 退出 我的 i 贴吧i 动态传送门我的动态我的俱乐部我的空间主页|空间装扮 博客|写新文章 相册|上传照片 好友|找新朋友 档案|留言板 我的应用新闻 网页 贴吧 知道 MP3 图片 视频 百科 吧内搜索 | 帮助 进入贴吧 进入 i 贴吧 贴子搜索 百度贴吧 高中化学吧 浏览贴子 吧主:硫酸亚铁铵 Cattigrew 快速回复 贴吧投诉 铜氧化皮清洗及铜快速除油.铜件在热处理后或者经过焊接处理,表面残留有致密的铜氧化层,给酸绍兴佰利嘉火泥熔接专业技.火泥熔接找绍兴佰利嘉电气,本公司研发,生产和销售接地铜棒,电缆佳联化工中国聚脲先锋聚脲提供优质的聚脲专利产品 聚脲最完善的聚脲供应商上海新仪-微波消解系统专.二十年生产研发经验产品远销美国,欧洲 上海市高新技术企业 021-销售纺织印染助剂一体的专.江阴市德玛化学有限公司是专业生产印染助剂的厂家.纺织印染助剂找优质多聚甲醛到临沂金源金源专供多聚甲醛 价格低质量好
2、 订购电话:0539-8438299 北京佳美兴提供化学镀镍光.北京佳美兴表面处理技术开发中心是专业从事化学镀镍技术研发的企黑孔化直接电镀替代化学沉.黑孔化直接电镀的出现对传统的 PTH 是个挑战,替代化学沉铜工艺,科华成 专业制造不锈钢设备华成不锈钢设备 全套塑材焊接加工设备 规模最大的塑质类耐腐蚀换斯达弗 宁波液压马达制造.液压马达强度高,内部元件承载能力大 斯达弗宁波液压马达质量可靠 转贴次数:0共有 12 篇贴子 酸碱理论(来自 化学小朋友) zlh_smile 1 位粉丝 1 楼酸碱是无机化学重要的组成部分,在有机化学中仍然是学习的一个重点。酸和碱在初中,高中,大学,甚至到了研究生都会逐步的学习,因此,可以说任何时候学习到的化学理论,几乎都是不完善的,在此,我介绍大家学习一下这个由一位外国教师编写的一课酸碱理论。其知识的深度以及广度我认为都是非常好的。虽然难度很大,不过仍然有很多是高中学生可以看的懂的。 在这里,我要提醒各位,不一定要全看懂,但是希望你阅览以后有收获,谢谢。 1.自然水中存在的酸和碱的例子最重要的碱:HCO3- 其他碱:硼酸根,磷酸根,氨,砷酸根,硫酸根,碳酸
3、根,等等 最终要的酸: CO2(aq)或者 H2CO3 其他酸:硅酸,铵根,硼酸,硫酸,乙酸(醋酸) ,乙二酸(草酸) 。大多数的酸碱反应在水溶液中是非常快速的(几乎是瞬时的);达到热力学平衡并且根据热力学原理可以计算出正确的收率. 酸碱 反应牵涉到质子,可是一个裸露的质子(氢原子)是不会在水溶剂中存在的,它是被水合,比如:成为水合氢离子或者更有可能生成 H9O4+ 2.Bronsted 定义 酸:一种物质可以释放出一个质子给任何其他的物质。 碱:一种物质可以从任何其他的物质那里接受一个质子。 3.酸和碱总是成对的进行反应 H2CO3 + H2O H3O+ + HCO3- NH4+ + H2O H3O+ + NH3 CH3COOH + H2O H3O+ + CH3COO- H2O + H2O H3O+ + OH- 4.一些定义 两性物 一种物质既可以作为酸也可以作为碱,比如:水,碳酸氢根离子。 多元酸或碱 一种酸或者碱可以分别释放或者接受多余一个质子,比如:H3PO4, H2CO3, H4EDTA (EDTA 酸) 5.简单的金属离子也是酸 所有的金属离子在水溶液中都被水合。被水合吸附
4、的水分子可以丢失一个质子,因此金属离子是一种酸。而金属离子的电荷决定了酸的强弱。 Zn(H2O)62+ + H2O H3O+ + Zn(H2O)5(OH)+ Cu(H2O)42+ + 3H2O 3H3O+ + Cu(H2O)(OH)3- 6.共扼酸碱对 HCl, Cl- H2CO3, HCO3- HSO4-, SO42- CH3COOH, CH3COO- Zn(H2O)62+, Zn(H2O)5(OH)+ 7.路易斯定义 酸:任何可以接受电子对的物质。 碱:任何可以给出电子对的物质。 9.酸或碱的强弱 强弱:给出或者接受质子的趋势,也就是:一种物质给出或者接受质子的难易。 弱酸有比较弱的质子给予趋势;强酸有很强的质子给予趋势。碱则同理。 10.绝对定义酸碱强弱是不可以的。 酸碱强弱取决于酸和碱之间的反应。 酸碱强弱的标准是相对于溶剂不同来说的,在这里,我们选用参照溶剂水。 11.酸碱强弱通过电离常数来定量比较 HA + H2O = H3O+ + A- 或者 HA = H+ + A- 两种电离或者可以理解为水解的方程式 Ka= (H+*A-) / HA Ka 值越大,酸性越强;Ka 越小
《chemistry 酸碱理论》由会员wm****3分享,可在线阅读,更多相关《chemistry 酸碱理论》请在金锄头文库上搜索。
 “严厉打击非法集资”主题活动主持稿-2
“严厉打击非法集资”主题活动主持稿-2
2023-08-15 5页
 简单 房屋租赁合同
简单 房屋租赁合同
2023-07-18 2页
 《医疗保障基金使用监督管理条例》测试题
《医疗保障基金使用监督管理条例》测试题
2023-04-07 5页
 餐饮行业食品安全问卷调查
餐饮行业食品安全问卷调查
2023-04-06 4页
 “阳康”大学生对运动软件选择偏好调研
“阳康”大学生对运动软件选择偏好调研
2023-04-06 3页
 90后工作状况社会调查
90后工作状况社会调查
2023-04-06 4页
 出租司机满意度调查表
出租司机满意度调查表
2023-04-06 3页
 虫鼠害控制管理制度培训试题
虫鼠害控制管理制度培训试题
2023-04-06 3页
 三年级数学第四单元测试卷2
三年级数学第四单元测试卷2
2023-04-06 2页
 三年级数学第四单元测试卷1
三年级数学第四单元测试卷1
2023-04-06 2页