
2021年物质结构与性质--高考化学知识点归纳最全面
4页1、名师归纳大肚能容,笑容可掬,更上一层楼物质结构与性质1、2、3 周期共 18 种元素4、5、6 周期共 72 种元素7 周期(未排满)第 1、 2、 13、 14、 15、 16、 17 纵列依次称为 第 A、 A、 A、 A、 A、 A、 A 族 第 3、 4、 5、6、 7、 11、 12 纵列依次称为第 B、 B、 B、 B、 B、 B、 B 族三短三长 一不全第第 第7个周期元 素 周 期表 地结构七主16 个族( 18 纵列)七副一八一零第 8、 9、 10 三纵列合称为第族()常考 Fe, Cu 及其离子地电子排布式)第 18 纵列称为零族(稀有气体元素s 区p 区 d 区 ds 区f 区第第 第第1、 2 两个纵列划为s 区( 价电子电子再s轨道 )1318 六个纵列划为p 区( 价电子再p 轨道 )310 八个纵列划为11、 12 两个纵列划为d 区( 价电子再d 轨道 )ds 区( 价电子再 d、 s轨道 )5 个区镧系与锕系元素属于f 区( 价电子再f 轨道)Ps : 价电子指原子核外电子中能与其他原子相互作用形成化学键地电子。第一部分:元素周期表知识点 1 单核微
2、粒半径大小判断规律( 1)( 2)( 3)先看电子层数,若不同,则层数多者微粒半径大(如:BrClF)+3+若电子层数相同,再看原子序数,序数小者半径大(如:Na MgAl)2+3+若为同种元素化合价不同地离子或原子,核外电子 多者半径大(如:FeFe Fe )知识点 2 有关周期与族地几个关系( 1)( 2)( 3)( 4)周期序数 =电子层数主族( A A)与副族 B、 B 族地族序数 =原子最外层地电子数(或 ns)。ns+np副族 B B 族地族序数零族:最外层电子数等于=最外层 s 电子数8 或 2。+次外层 d 电子数。第二部分:元素周期律知识点周期律基本内容1原子序数电子层数最外层电子数原子半径主要化合价横行增大不变增多减小增大纵列增大增大不变增大不变行与行间周期性变化1By: Shadow第 1 页,共 4 页名师归纳大肚能容,笑容可掬,更上一层楼知识点 2 同周期、同主族元素性质递变规律1、元素原子失电子(还原性)能力强弱比较依据( 1)依据金属活动性顺序表,越靠前元素原子失电子能力越强。( 2)比较元素单质与水(或酸)地反应置换出氢地难易程度。越易发生,失电子能力越
3、强。( 3)比较元素最高价氧化物对应水化物碱性强弱。碱性越强,失电子能力越强。( 4)根据金属与盐溶液间地置换反应,失电子能力强地置换成失电子能力弱地。2+( 5)一般金属阳离子地氧化能力越强,则对应地金属单质地还原性越弱(Fe 对应地为Fe )( 6)电化学原理:不同金属形成原电池时,通常作负极地金属性强;再电解池中地惰性电极上,先析出地金属性弱。2、元素得电子(氧化性)能力强弱比较依据( 1)比较元素单质与氢气化合地难易程度。一般越易反应,得电子能力越强。( 2)比较其气态氢化物地稳定性。越稳定得电子能力越强。( 3)比较元素最高价氧化物对应水化物地酸性。酸性越强,得电子能力越强。( 4)依据非金属单质间地置换反应。氧化剂比氧化产物地得电子能力强。3、同周期、同主族元素性质递变规律( 1)同一周期,随着原子序数递增,失电子能力 (一般指金属)减弱,还原性减弱,金属地金属性减弱; 得电子能力 (一般指非金属)增强,氧化性增强,非金属地非金属性增强。( 2)同一主族,随着原子序数递增,失电子能力 (一般指金属)增强,还原性增强,金属地金属性增强; 得电子能力 (一般指非金属)减弱,氧化
《2021年物质结构与性质--高考化学知识点归纳最全面》由会员氟****分享,可在线阅读,更多相关《2021年物质结构与性质--高考化学知识点归纳最全面》请在金锄头文库上搜索。

2023-2024学年浙江省宁波市初中生物八年级期末通关试卷详细答案和解析

2023-2024学年河南省信阳市小学数学五年级期末评估测试题详细答案和解析
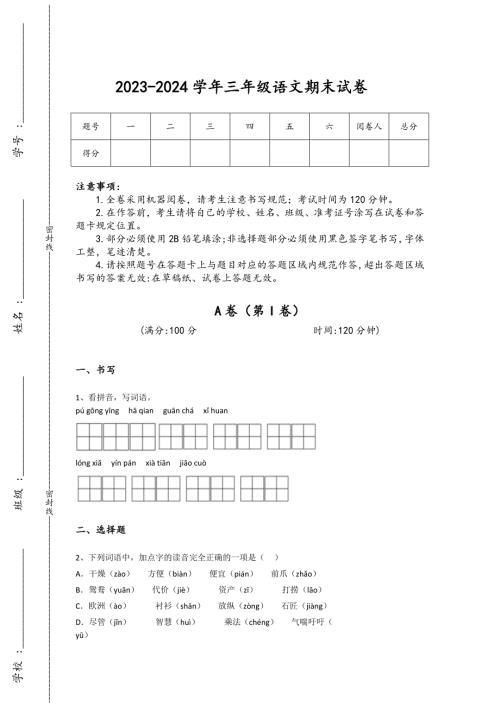
2023-2024学年江西省信州区小学语文三年级期末提升测试题详细参考答案解析
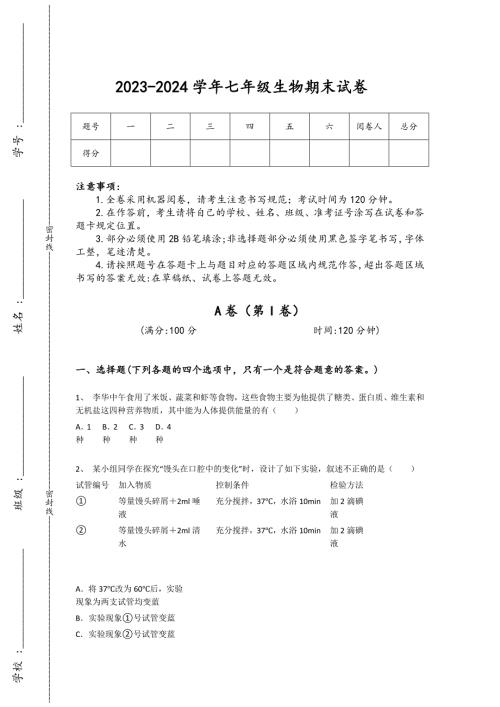
2023-2024学年内蒙古自治区通辽市初中生物七年级期末高分测试题详细答案和解析

2023-2024学年安徽省阜阳市初中物理八年级期末自我评估题详细答案和解析
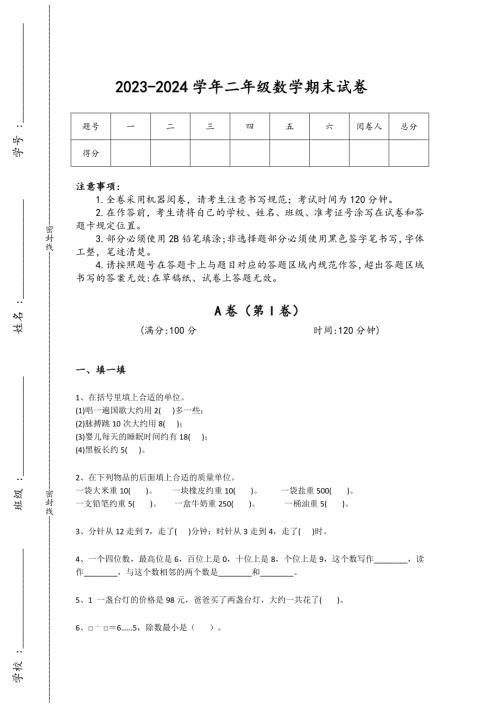
2023-2024学年黑龙江省安达市小学数学二年级期末高分通关试题详细答案和解析
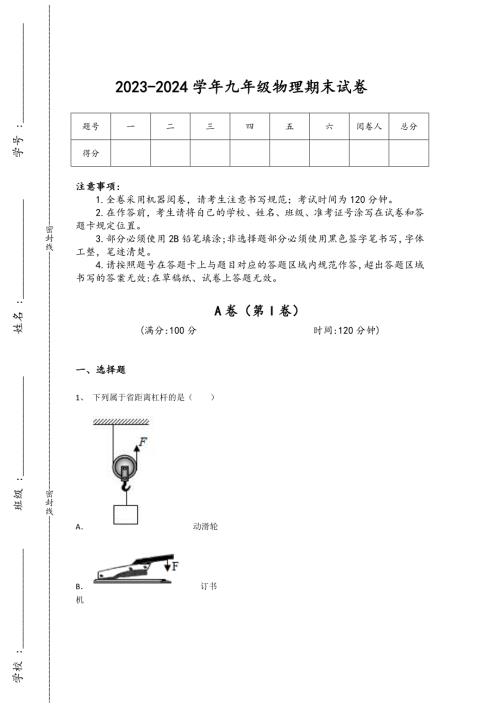
2023-2024学年山西省朔州市初中物理九年级期末自我评估提分卷详细答案和解析

2023-2024学年山东省泰安市初中生物七年级期末评估试题详细答案和解析

2023-2024学年浙江省乐清市初中生物九年级期末自我评估试题详细答案和解析
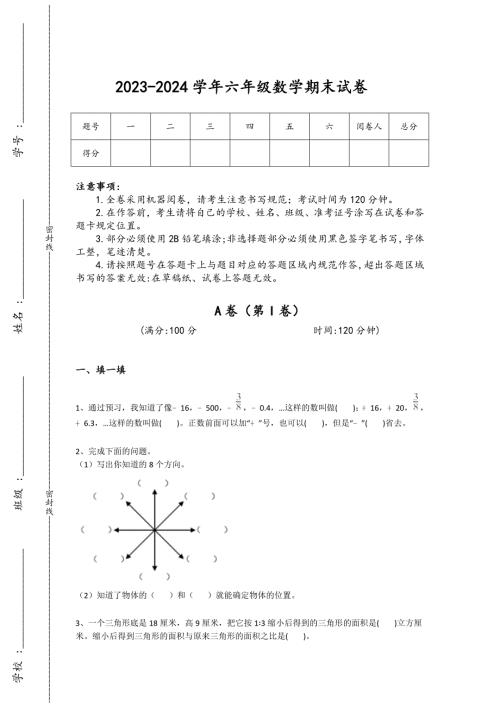
2023-2024学年浙江省建德市小学数学六年级期末提升试卷详细答案和解析

2023-2024学年黑龙江省同江市初中物理八年级期末自测模拟题详细答案和解析
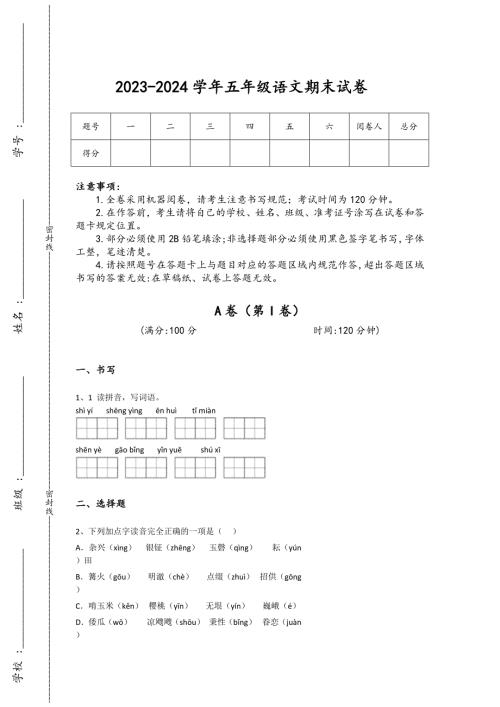
2023-2024学年云南省楚雄市小学语文五年级期末通关试卷详细参考答案解析

高考数学指数函数对数函数幂函数专题复习1高考

央财金融硕士复习经验方法凯程学员徐q财经资料
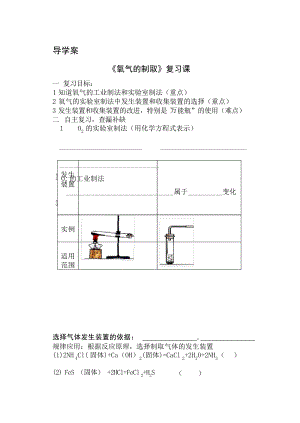
氧气的制取复习课导学案中学学案

人教版四年级下册第三单元《运算定律和简便运算》整理和复习教案小学教育

高考物理一轮复习 专题36 测定金属的电阻率测含解析人教版高三全册物理试题试题

高考物理一轮复习 专题50 光电效应 波粒二象性练含解析人教版高三全册物理试题高中教育

一年级下学期语文全部复习资料最好中考

高考政治总复习配套练习必修 第二单元第六课针对训练1高考
 广西壮族自治区贵港市2024届高三下学期最后一卷 英语 Word版含解析
广西壮族自治区贵港市2024届高三下学期最后一卷 英语 Word版含解析
2024-05-31 33页
 福建省福州市八县市一中2024届高三下学期5月模拟试题 政治 Word版含解析
福建省福州市八县市一中2024届高三下学期5月模拟试题 政治 Word版含解析
2024-05-31 12页
 江西省上进联考2024届高三下学期5月高考适应性大练兵试题 物理 Word版含解析
江西省上进联考2024届高三下学期5月高考适应性大练兵试题 物理 Word版含解析
2024-05-31 11页
 重庆市乌江新高考协作体2024届高三下学期第三次模拟预测试题 历史 Word版含解析
重庆市乌江新高考协作体2024届高三下学期第三次模拟预测试题 历史 Word版含解析
2024-05-31 11页
 广西壮族自治区贵港市2024届高三下学期最后一卷 物理 Word版含解析
广西壮族自治区贵港市2024届高三下学期最后一卷 物理 Word版含解析
2024-05-31 14页
 福建省福州市八县市一中2024届高三下学期5月模拟试题 化学 Word版含答案
福建省福州市八县市一中2024届高三下学期5月模拟试题 化学 Word版含答案
2024-05-31 5页
 江西省上进联考2024届高三下学期5月高考适应性大练兵试题 语文 Word版含解析
江西省上进联考2024届高三下学期5月高考适应性大练兵试题 语文 Word版含解析
2024-05-31 16页
 重庆市乌江新高考协作体2024届高三下学期第三次模拟预测试题 化学 Word版含解析
重庆市乌江新高考协作体2024届高三下学期第三次模拟预测试题 化学 Word版含解析
2024-05-31 23页
 江西省上进联考2024届高三下学期5月高考适应性大练兵试题 历史 Word版含解析
江西省上进联考2024届高三下学期5月高考适应性大练兵试题 历史 Word版含解析
2024-05-31 11页
 江西省上进联考2024届高三下学期5月高考适应性大练兵试题 数学 Word版含解析
江西省上进联考2024届高三下学期5月高考适应性大练兵试题 数学 Word版含解析
2024-05-31 14页

