
高考化学压轴题专题复习——铁及其化合物推断题的综合及答案解析
12页1、高考化学压轴题专题复习铁及其化合物推断题的综合及答案解析一、铁及其化合物1某强酸性溶液 X 中可能含有 Fe2、Fe3、Al3、Ba2、NH4、CO32、NO3、SO42、SiO32中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。根据以上信息,回答下列问题:(1)由强酸性条件即可判断 X 溶液中肯定不存在的离子有_。(2)溶液 X 中关于硝酸根离子的判断,正确的是_(填编号,下同)。a一定含有 b一定不含有 c可能含有(3)气体 F 的电子式为_,化合物 I 中含有的化学键类型有_。(4)转化的离子方程式为_。 转化的离子方程式为_。(5)对不能确定是否存在的离子,可以另取 X 溶液,加入下列溶液中的一种,根据现象即可判断, 该试剂最好是_。NaOH 溶液 KSCN 溶液 氯水和 KSCN 的混合溶液 pH 试纸 KMnO4 溶液【答案】CO32、SiO32 b 共价键和离子键 3Fe2+ +4H+ +NO3= 3Fe3+NO + 2H2O AlO22H2OCO2=HCO3Al(OH) 3 【解析】【分析】某强酸性溶液X中一定含有氢离子,一
2、定不含CO32、SiO32,加过量的硝酸钡溶液,产生白色沉淀C是硫酸钡,一定含有SO42,一定不含Ba2+,产生气体A一定是亚铁离子和硝酸根离子、氢离子发生氧化还原反应得到的NO,所以一定含有Fe2+,一定不含NO3,NO遇到氧气转化为气体D为二氧化氮,二氧化氮与水、氧气反应生成溶液E为硝酸溶液,溶液B中加入过量氢氧化钠生成气体F,F为氨气,则原溶液中一定含有NH4,氨气和硝酸溶液反应生成I为硝酸铵,溶液H中通入过量二氧化碳产生沉淀K和溶液L,沉淀K一定为氢氧化铝,原溶液中一定含有Al3+,L是NaHCO3,溶液B中生成的有铁离子,所以沉淀G是Fe(OH)3,溶于盐酸得到J为氯化铁溶液,但原溶液中不一定含有Fe3。【详解】(1). 由强酸性条件即可判断X溶液中肯定不存在的离子有CO32、SiO32,故答案为CO32、SiO32;(2).根据上述分析可知,原溶液中一定会有H+、Fe2,则一定不含NO3,故答案为b;(3).气体F为NH3,电子式为,氨气和硝酸溶液反应生成化合物I为硝酸铵,硝酸铵中含有共价键和离子键,故答案为;共价键和离子键;(4).由上述分析可知,转化为H+、NO3和Fe
3、2发生氧化还原反应生成Fe3、NO和水,离子方程式为3Fe2+ +4H+ +NO3= 3Fe3+NO + 2H2O,转化为过量CO2与AlO2、H2O反应生成Al(OH) 3沉淀和HCO3,离子方程式为AlO2+2H2O+CO2=HCO3Al(OH) 3 ,故答案为3Fe2+ +4H+ +NO3= 3Fe3+NO + 2H2O;AlO2+2H2O+CO2=HCO3Al(OH) 3 ;(5).由上述分析可知,不能确定X溶液中是否含有Fe3,检验Fe3最好的是试剂是KSCN溶液,故答案为。【点睛】本题考查离子的检验和推断,明确常见离子的性质是解题的关键,注意加入过量硝酸钡溶液能够生成气体,说明X溶液中一定含有Fe2和NO3,反应生成的溶液B中一定有Fe3,所以无法判断X溶液中是否含有Fe3,为易错点。2室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E是无色溶液,F是淡绿色溶液。B和C反应发出苍白色火焰。请回答:(1)A是_,B是_,C是_(请填写化学式);(2)反应的化学方程式_;(3)反应的离子方程式_;(4)反应的离子方
4、程式_。【答案】Fe Cl2 H2 2Fe+3Cl22FeCl3 Fe2HFe2H2 2Fe2Cl22Fe32Cl 【解析】【分析】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体,B是氯气,B和C反应发出苍白色火焰,C是氢气,E是氯化氢。F是淡绿色溶液,F溶液中含有亚铁离子,所以A是铁,F是氯化亚铁,D是氯化铁,据以上分析解答。【详解】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体,B是氯气,B和C反应发出苍白色火焰,C是氢气,E是氯化氢。F是淡绿色溶液,F溶液中含有亚铁离子,所以A是铁,F是氯化亚铁,D是氯化铁,(1)根据以上分析可知A、B、C分别是Fe、Cl2、H2;(2)反应为铁与氯气反应生成氯化铁,化学方程式为2Fe+3Cl22FeCl3;(3)反应为铁与盐酸反应生成氯化亚铁和氢气,离子方程式为Fe2HFe2H2;(4)反应为氯化亚铁与氯气反应生成氯化铁,离子方程式为2Fe2Cl22Fe32Cl。3现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)根据以上信息填空:(1)
《高考化学压轴题专题复习——铁及其化合物推断题的综合及答案解析》由会员热****分享,可在线阅读,更多相关《高考化学压轴题专题复习——铁及其化合物推断题的综合及答案解析》请在金锄头文库上搜索。

2022年二级建造师习题 施工管理
2022年JG二建市政习题班讲义 导学
2022年JG二建市政习题班讲义综合管理

2022年JG二建市政基础班讲义 生活垃圾填埋处理工程

2022年JG二建市政基础班讲义 施工测量与监控量测
2022年JG二建市政基础班讲义 市政公用工程项目施工相关法规与标准

2022年二级建造师水利零基础预习

施工进度计划的类型及其作用

公路工程施工现场临时工程管理
2022年二建管理精讲 施工成本核算、成本分析和成本考核

公路工程施工机械设备的使用管理

2022二建施工管理临考串讲

2022年二建管理精讲 职业健康安全管理体系与环境管理体系
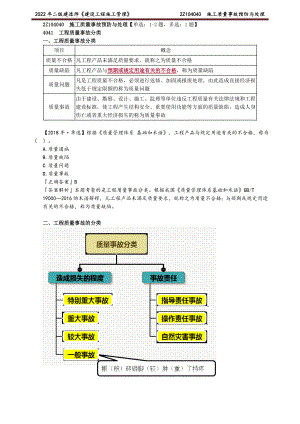
2022年二建管理精讲 施工质量事故预防与处理
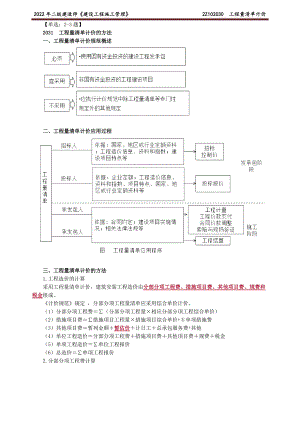
2022年二建管理精讲 工程量清单计价
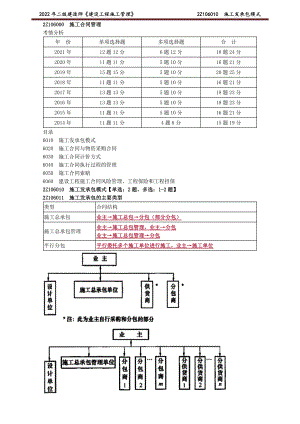
2022年二建管理精讲 施工发承包模式

二级建造师(机电工程)注册执业管理规定及相关要求

2022年二建管理精讲 施工成本计划和成本控制

2022年二建管理精讲 施工质量控制的内容和方法

隧道围岩分级与隧道构造
 分户验收工作的思考与总结
分户验收工作的思考与总结
2023-05-21 6页
 劳技中心课件制作比赛方案
劳技中心课件制作比赛方案
2022-08-26 2页
 开展土地整理基本状况调研报告
开展土地整理基本状况调研报告
2022-11-06 4页
 汕头关于成立网络安全技术开发公司可行性报告模板范本
汕头关于成立网络安全技术开发公司可行性报告模板范本
2024-03-13 182页
 汽车传感器公司监事会方案【参考】
汽车传感器公司监事会方案【参考】
2024-02-05 52页
 单层钢结构厂房吊装方案
单层钢结构厂房吊装方案
2022-10-02 38页
 南京抗生素项目投资计划书范文参考
南京抗生素项目投资计划书范文参考
2022-09-03 126页
 景德镇市道路交通安全项目分析报告范文模板
景德镇市道路交通安全项目分析报告范文模板
2023-04-27 95页
 来宾光伏照明技术服务项目申请报告
来宾光伏照明技术服务项目申请报告
2023-09-05 215页
 第四人民医院志愿服务心得
第四人民医院志愿服务心得
2023-10-27 2页

