
基于细胞荧光原位杂交法的人类染色体异常检测试剂-注册技术审查指导原则
16页1、附件1基于细胞荧光原位杂交法的人类染色体异常检测试剂注册技术审查指导原则本指导原则旨在指导注册申请人对基于细胞荧光原位杂交法(Fluorescence In Situ Hybridization,FISH)的人类染色体异常检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对基于细胞荧光原位杂交法的人类染色体异常检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。本指导原则是供申请人和审查人员使用的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。一、适用范围本指导原则所述染色体异常的类型包括染色体数目异常、结构异常(包括异位,倒位导致的基因断裂和融
2、合)、扩增、缺失等,例如,产前羊水细胞中的染色体数目异常,白血病患者骨髓细胞中的BCR/ABL基因融合等。检测人类染色体异常的方法有染色体核型分析、原位杂交法、PCR法和高通量测序法等,不同方法在检测染色体异常类型、片段大小、操作要求等方面具有不同特点。本指导原则适用于需进行注册审批方可上市的采用荧光原位杂交法检测人类细胞样本中染色体异常的检测试剂。荧光原位杂交法是指根据碱基互补配对原则,在与目标DNA配对的核酸片段上标记荧光染料(探针),该探针与待检样本中相应的核酸片段在一定条件下特异结合(杂交),形成双链核酸,借助于荧光显微镜观察并记录形成杂交双链的类型、数量和所处染色体区带位置,从而判断待检样本中是否存在染色体异常的检测方法。本指导原则是基于荧光原位杂交法撰写而成,对于显色原位杂交法和银增强原位杂交法等亮视野原位杂交法不适用。本指导原则适用样本类型为人类细胞样本,不适用于在石蜡包埋的细胞学和组织学切片上进行检测的试剂和微生物检测试剂。本文是针对采用荧光原位杂交法检测人类细胞样本中染色体异常的检测试剂的通用指导原则,申请人应结合具体产品的特点进行注册申报。如果申报产品有具体指导原则
3、,应按照执行。本指导原则适用于进行产品注册和相关许可事项变更的产品,包括申报资料中部分项目要求,其他未尽事宜,应当符合体外诊断试剂注册管理办法(国家食品药品监督管理总局令第5号,以下简称办法)等相关法规要求。二、注册申报资料要求注册申报资料的撰写应符合关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(国家食品药品监督管理总局公告2014年第44号)(以下简称2014年第44号公告)的相关要求。内容主要包括:(一)综述资料1.产品预期用途。描述产品的预期用途,与预期用途相关的临床背景情况。说明检测的位点和靶序列(Target Sequence,TS),包括靶序列的长度、异常类型和特异性信息。说明相关的临床适应症,该异常在适应症中的发生情况和频率,适应症的发生率、适用人群等。说明具体临床意义,例如:是否用于诊断、分型、治疗方案选择、预后判断、微量残留病监测等。介绍相关的临床或实验室诊断方法。2.产品描述。描述产品所采用的技术原理,包括杂交反应和信号结果。描述主要原材料的来源及制备方法,主要生产工艺过程,参考品的制备和确认方法。3.有关生物安全性方面的说明。4.有关产品主要研究结
4、果的总结和评价。5.其他。包括同类产品在国内外批准上市的情况。对同类产品所采用的技术方法、检测位点、样本类型、荧光信号标记及临床应用等进行对比分析,以阐明申请注册产品与国内外同类产品的优势和局限性。对于新研制的体外诊断试剂产品,需要提供被测物与预期临床适应症之间关系的文献资料。(二)主要原材料研究资料应提供主要原材料的来源选择、制备过程、质量分析和质量控制标准等研究资料。如主要原材料为企业自己生产,其生产工艺必须稳定可控;如主要原材料为购自其他供应商,应详述每一原材料的外购方来源,外购方提供的质量标准、出厂检定报告或性能指标证书,以及该原材料到货后的质量检验资料。1.探针:明确探针类型(序列特异性探针、着丝粒探针等),提供该探针序列的选择依据,明确结合位点的序列长度和染色体区带位置,可采用FISH分析结合染色体显带的方法进行定位。如检测位点存在多种异常形式(例如断裂点不同),应合理设计探针避免漏检。探针结合位点的基因组图谱位置应具有特异性,检索基因组数据库,如果发现靶序列与基因组其他区域的序列具有同源性,应进行评估,尽量避免交叉杂交信号的出现。应对探针的浓度、纯度及标记的荧光信号基团进
《基于细胞荧光原位杂交法的人类染色体异常检测试剂-注册技术审查指导原则》由会员木92****502分享,可在线阅读,更多相关《基于细胞荧光原位杂交法的人类染色体异常检测试剂-注册技术审查指导原则》请在金锄头文库上搜索。

特别重大自然灾害损失综合评估导则(报批稿)

安徽省自然资源标准化工作三年行动计划(2024-2026年)

关于深入推进矿山智能化建设促进矿山安全发展的指导意见

知识产权尽职调查材料清单、流程、常用网站
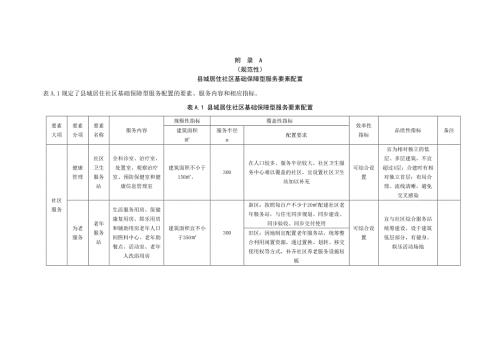
县城居住社区基础保障型服务、品质提升型服务要素配置

陕西省矿产资源节约和综合利用先进适用技术目录(2024版)

关于本市电动自行车停放场所和充电设施规划资源实施意见

光伏系统施工质量验收表格、光伏建筑一体化系统巡检周期表

牛大力主要病虫害及防治方法

化妆品检查管理办法

职业卫生技术服务机构专业技术人员要求、主要仪器设备要求、第一类业务范围检测项目表

职业卫生技术服务机构资质申请表、承诺书、材料要求、资质证书样式、变更延续申请表

实景三维数据赋能高质量发展创新应用典型案例申报表

茶园杂草危害评价方法、广东茶园杂草种类

城市供水原水水质标准(修订征)

既有民用建筑检查标准(征)
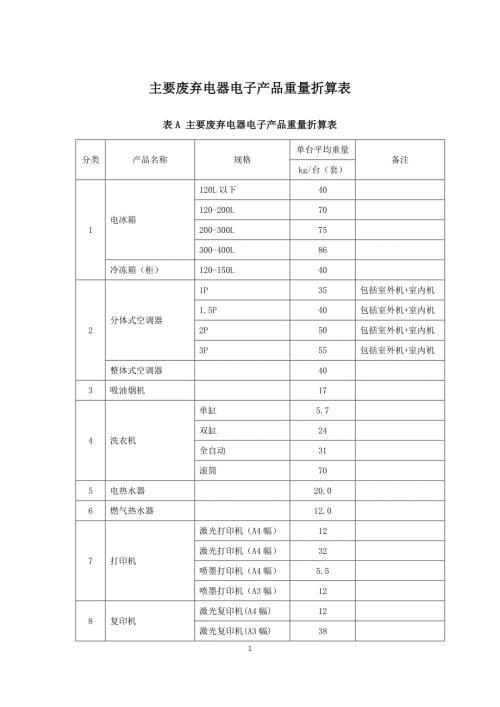
主要废弃电器电子产品重量折算表

职业卫生技术服务机构资质认可程序
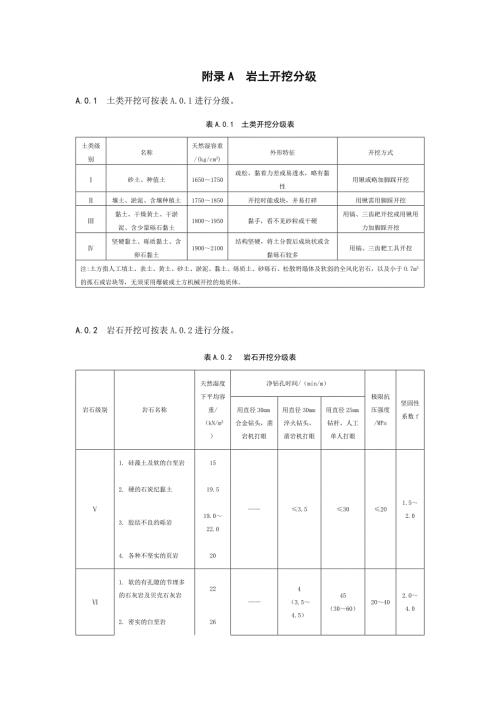
岩土开挖分级、掏槽眼布置技术参数、探硐施工条件适宜性评价、坑探地质编录图式、质量验收表

供应链信息路由控制示例
 江西省南昌市进贤县高二上学期期末联考语文试题
江西省南昌市进贤县高二上学期期末联考语文试题
2023-04-20 31页
 北师大版春风同步练习
北师大版春风同步练习
2024-01-23 3页
 蚌埠电解铝项目申请报告_范文参考
蚌埠电解铝项目申请报告_范文参考
2022-12-24 104页
 长春版2019-2020学年一年级上学期语文期中测试试卷C卷新版
长春版2019-2020学年一年级上学期语文期中测试试卷C卷新版
2024-02-15 4页
 乡镇污水处理厂应急水池项目建议书写作模板-立项申请备案
乡镇污水处理厂应急水池项目建议书写作模板-立项申请备案
2023-08-03 63页
 竹茶饮料项目资金申请报告写作模板-代写定制
竹茶饮料项目资金申请报告写作模板-代写定制
2023-02-15 98页
 栈桥施工方案范文
栈桥施工方案范文
2022-08-10 4页
 荧光原位杂交探针项目创业计划书写作模板
荧光原位杂交探针项目创业计划书写作模板
2023-11-16 41页
 买卖合同软件购销合同
买卖合同软件购销合同
2022-08-06 29页
 2019年暑假实习报告范文
2019年暑假实习报告范文
2024-02-23 5页

