
硝酸计算专题训练
5页1、精选优质文档-倾情为你奉上硝酸计算(4.15)1、(1)2 mol 铜与8 mol 稀硝酸充分反应,求生成气体的物质的量?(2)4 mol 铜与8 mol 稀硝酸充分反应,求生成气体的物质的量?2、(1)将8 mol 铜放入4 mol 稀硝酸和3 mol 稀硫酸的混合液中,求生成气体的物质的量?(2)将8 mol 铜放入4 mol 稀硝酸和10 mol 稀硫酸的混合液中,求生成气体的物质的量?(3)将13mol 铜放入8 mol 稀硝酸中反应,欲将溶液中的硝酸根离子全部转化为NO,还需加入至少多少mol 稀硫酸?(4)将10mol 锌放入4 mol 稀硝酸和8 mol 稀硫酸的混合液中,求生成气体的物质的量? 3、将19.2 g铜投入盛有足量硝酸铝溶液的试管中,铜不溶解,再滴加稀硫酸,铜逐渐溶解,管口附近有红棕色气体出现,写出铜溶解的离子方程式( );若要将铜完全溶解,至少加入硫酸的物质的量是( )4、将1.92 g铜粉投入到某硫酸和硝酸的混合溶液中,其中,硫酸和硝酸的浓度均为1 mol/L,溶液体积为40 mL,待充分反应后若只生成NO气体,则最多可收集到标准状况下的NO的体积为(
2、)A.336 mL B.112 mL C.448 mL D.224 mL5、在100 mL混合酸的溶液中,硝酸的物质的量浓度为0.5 mol/L,硫酸的物质的量浓度为0.15 mol/L,向其中加入5.76 g铜粉,微热,使其充分反应。(1)求溶液中铜离子的浓度;(2)若要使5.76 g铜粉完全溶解,且溶液中只存在一种盐,则原溶液中的硝酸和硫酸的物质的量浓度分别为多少?硝酸计算(4.17)6、若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),则(1)所消耗的硝酸的物质的量为?(2)所得气体的平均相对分子质量为?7、在一定稳定下,某浓度的硝酸与金属锌反应生成NO2和NO,两者的物质的量之比为1 :3,则要使1 mol 金属锌完全反应,需要硝酸的物质的量为( )A.2.8 mol B.2.6 mol C.2.4 mol D.0.8 mol8、将32.64g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO混合气体在标准状况下的体积为11.2 L。请回答:(1)NO的体积为_L,NO2的体积为_L。(2)待产生的气体全部释放后,向溶液中加入V
3、mL a molL1的NaOH溶液,恰好使溶液中的Cu2全部转化成沉淀,则原硝酸溶液的浓度为_molL1。(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水_g。9、足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2恰好完全沉淀,则消耗溶液中NaOH的体积是?10、锌和某浓度的硝酸溶液反应时,若参加反应的锌与硝酸的物质的量之比为2 :5,产物有硝酸锌、X和水,则X可能是( ) A.NO B.N2O C.N2O3 D.NO2 E. NH4NO311、锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体35.84 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+) = 0.1 mol/L,下列叙述不正确的是( )A.反应中共消耗1.8 mol H2SO4 B.生成的气体中SO2与H2的体积比为7 :1C.反应中共消耗1.6 mol Zn
《硝酸计算专题训练》由会员汽***分享,可在线阅读,更多相关《硝酸计算专题训练》请在金锄头文库上搜索。

出租车转让合同常用版(5篇)

2023租房合同格式版(8篇).doc

乒乓球兴趣小组活动计划

售房委托书合集5篇

【最新】高中全程训练计划历史仿真二 含解析

长春电子化学品技术服务项目可行性研究报告

路桥技术员年末工作总结

好看的儿童画

小学远程教育工作部署

数学上册期末复习计划---六年级组

外科护理学含皮肤护理

世界地理常识
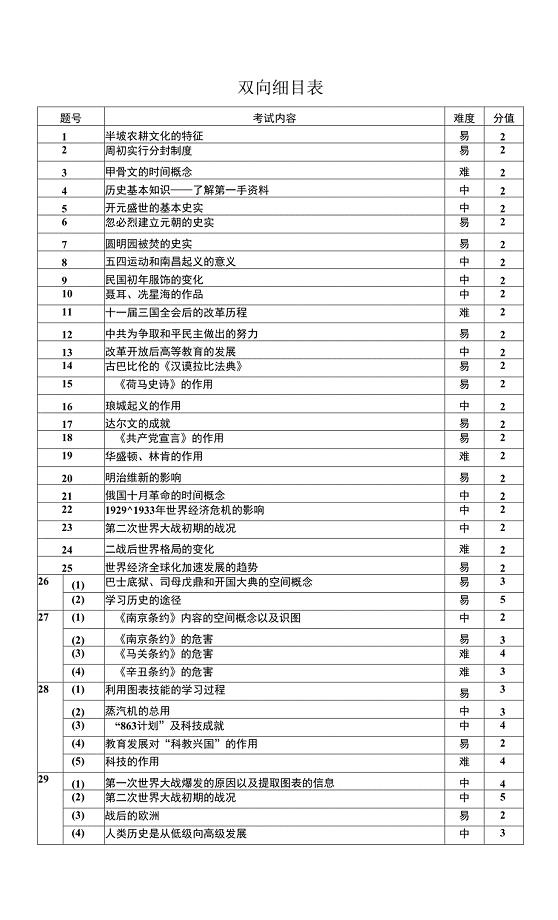
双向细目表.docx

2023年观看“双百”活动专场报告会的心得体会5篇

马铃薯保鲜存储库项目可行性研究报告写作模板-代写定制

2023年G锅炉作业《(G1)工业锅炉司炉》安全生产模拟考试题

学校教代会工作制度常用版(3篇).doc

2023年二级建造师历年试题及答案

北京小升初语文文学常识题2

教员师德师风自查报告
 线性代数知识点总结(共8页)
线性代数知识点总结(共8页)
2023-12-04 8页
 WL8-004第二节-运动的描述导学案附教学反思
WL8-004第二节-运动的描述导学案附教学反思
2023-07-21 2页
 安全防范系统资料
安全防范系统资料
2023-10-04 16页
 2013酒店无线方案建议书(最新方案)解析
2013酒店无线方案建议书(最新方案)解析
2024-02-07 18页
 年产xxx套无人机项目实施方案
年产xxx套无人机项目实施方案
2022-10-26 98页
 2015年河北省注册会计师考试《审计》:PPS抽样试题
2015年河北省注册会计师考试《审计》:PPS抽样试题
2023-05-14 9页
 最新高层煤矸石空心砖填充墙砌筑技术交底
最新高层煤矸石空心砖填充墙砌筑技术交底
2024-01-10 13页
 生活中常用到20个急救小知识
生活中常用到20个急救小知识
2023-09-05 6页
 小学数学获奖评课稿(共4页)
小学数学获奖评课稿(共4页)
2023-01-03 4页
 室内热水供应系统
室内热水供应系统
2023-11-01 4页

